Aluminium bromida adalah senyawa yang dibentuk oleh atom aluminium dan kuantitas atom bromin bervariasi. Itu terbentuk tergantung pada jumlah elektron valensi yang dimiliki aluminium.
Menjadi senyawa yang disatukan oleh logam (aluminium) dan non-logam (bromin), ikatan kovalen terbentuk yang memberikan struktur stabilitas yang sangat baik, tetapi tanpa mencapai ikatan ion .
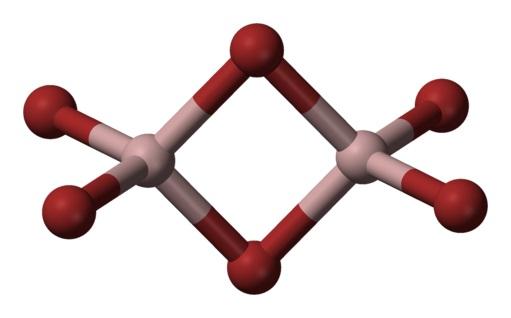
Aluminium bromida adalah zat yang biasanya terjadi dalam keadaan padat , dengan struktur kristal.
Warna dari aluminium bromida yang berbeda muncul sebagai kuning pucat dengan warna yang berbeda, dan terkadang muncul tanpa warna yang jelas.
Warna tergantung pada kapasitas refleksi cahaya senyawa dan perubahan tergantung pada struktur yang dibuat dan bentuk yang diambilnya.
Bentuk padat dari senyawa ini mengkristal, sehingga mereka memiliki struktur yang jelas dengan penampilan yang mirip dengan garam laut, tetapi warnanya bervariasi.
Rumus Aluminium Bromida
Aluminium bromida terdiri dari atom aluminium (Al) dan jumlah atom brom (Br) yang berbeda, tergantung pada elektron valensi yang dimiliki aluminium.
Oleh karena itu, rumus umum aluminium bromida dapat ditulis sebagai berikut: AlBrx, di mana “x” adalah jumlah atom brom yang mengikat aluminium.
Bentuk paling umum yang terjadi adalah sebagai Al2Br6, yang merupakan molekul dengan dua atom aluminium sebagai basa utama strukturnya.
Ikatan di antara mereka dibentuk oleh dua brom di tengah, sehingga setiap atom aluminium memiliki empat atom Brom dalam strukturnya, tetapi pada gilirannya, mereka berbagi dua.
Sifat Aluminium Bromida
Karena sifatnya, sangat larut dalam air tetapi juga sebagian larut dalam senyawa seperti metanol dan aseton, tidak seperti jenis zat lainnya.
Ini memiliki berat molekul 267 g / mol dan terdiri dari ikatan kovalen.
Natrium bromida mencapai titik didihnya pada 255 ° C, dan mencapai titik lelehnya pada 97,5 ° C.
Ciri-ciri lain dari senyawa ini adalah mengeluarkan racun saat menguap, jadi tidak disarankan untuk bekerja dengannya pada suhu tinggi tanpa perlindungan yang memadai dan pengetahuan keselamatan yang relevan.
Kegunaan Aluminium Bromida
Salah satu kegunaan yang diberikan untuk jenis zat ini karena sifat logam dan non-logamnya adalah sebagai agen dalam uji kemurnian kimia.
Pengujian kemurnian sangat penting dalam menentukan kualitas reagen dan membuat produk yang membuat orang puas.
Dalam penelitian ilmiah itu digunakan dengan cara yang sangat bervariasi. Misalnya, untuk membentuk struktur kompleks, agen dalam sintesis produk kimia berharga lainnya, dalam hidrogenasi dihidroksinaftalena dan dalam selektivitas dalam reaksi, di antara kegunaan lainnya.
Senyawa ini tidak populer secara komersial. Seperti yang terlihat di atas, ia memiliki beberapa kegunaan yang sangat spesifik, tetapi sangat menarik bagi komunitas ilmiah.
Referensi
- Chang, R. (2010). Kimia (edisi ke-10.) McGraw-Hill Interamericana.
- Krahl, T., & Kemnitz, E. (2004). Aluminium bromida fluorida amorf (ABF). Angewandte Chemie – Edisi Internasional, 43 (48), 6653-6656. doi: 10.1002 / anie.200460491
- Golounin, A., Sokolenko, V., Tovbis, M., & Zakharova, O. (2007). Kompleks nitronaftol dengan aluminium bromida. Jurnal Kimia Terapan Rusia, 80 (6), 1015-1017. doi: 10.1134 / S107042720706033X
- Koltunov, KY (2008). Kondensasi naftalenadiol dengan benzena dengan adanya aluminium bromida: Sintesis yang efisien dari 5-, 6-, dan 7-hidroksi-4-fenil-1- dan 2-tetralon. Surat Tetrahedron, 49 (24), 3891-3894. doi: 10.1016 / j.tetlet.2008.04.062
- Guo, L., Gao, H., Mayer, P., & Knochel, P. (2010). Persiapan reagen organoaluminium dari bromida propargilik dan aluminium yang diaktifkan oleh PbCl2 dan adisi regio- dan diastereoselektifnya pada turunan karbonil. Kimia-a Jurnal Eropa, 16 (32), 9829-9834. doi: 10.1002 / kimia.20000523
- Ostashevskaya, LA, Koltunov, KY, & Repinskaya, IB (2000). Hidrogenasi ion dihidroksinaftalena dengan sikloheksana dengan adanya aluminium bromida. Jurnal Kimia Organik Rusia, 36 (10), 1474-1477.
- Iijima, T., & Yamaguchi, T. (2008). Karboksilasi regioselektif yang efisien dari fenol menjadi asam salisilat dengan CO2 superkritis dengan adanya aluminium bromida. Jurnal Katalisis Molekuler A: Kimia, 295 (1-2), 52-56. doi: 10.1016 / j.molcata.2008.07.017
- Murachev, VB, Byrikhin, VS, Nesmelov, AI, Ezhova, EA, & Orlinkov, AV (1998). Studi spektroskopi 1H NMR dari sistem inisiasi kation tert-butil klorida – aluminium bromida. Buletin Kimia Rusia, 47 (11), 2149-2154.