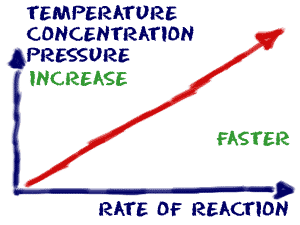
Faktor-faktor yang mempengaruhi laju reaksi dari reaksi kimia termasuk konsentrasi reaktan, suhu, keadaan fisik reaktan dan dispersinya, pelarut, dan adanya katalis.
Pengantar laju reaksi
Meskipun persamaan kimia yang seimbang untuk suatu reaksi menggambarkan hubungan kuantitatif antara jumlah reaktan yang ada dan jumlah produk yang dapat dibentuk, itu tidak memberi kita informasi tentang apakah atau seberapa cepat laju reaksi yang diberikan akan terjadi.
Informasi tentang laju reaksi diperoleh dengan mempelajari kinetika kimia suatu reaksi, yang tergantung pada berbagai faktor: konsentrasi reaktan, suhu, keadaan fisik dan luas permukaan reaktan, dan sifat pelarut dan katalis jika ada. Dengan mempelajari kinetika suatu reaksi, ahli kimia memperoleh wawasan tentang bagaimana mengendalikan kondisi laju reaksi untuk mencapai hasil yang diinginkan.
Faktor-faktor yang mempengaruhi laju reaksi
Pengaruh Konsentrasi
Konsentrasi adalah faktor pertama yang mempengaruh laju reaksi dalam reaksi kimia. Kenapa ini mempengaruhi laju reaksi?
Jika tidak ada kontak antara dua zat yang bereaksi, laju reaksi akan menjadi nol. Sebaliknya, semakin banyak partikel reaktan yang bertumbukan per satuan waktu, semakin sering terjadi reaksi di antara mereka sehingga laju reaksinya bertambah. Akibatnya, laju reaksi biasanya meningkat dengan meningkatnya konsentrasi reaktan.
Pengaruh suhu
Suhu adalah faktor berikutnya yang akan meningkatkan laju reaksi. Meningkatkan suhu sistem akan meningkatkan energi kinetik rata-rata partikel penyusunnya dan ini berdampak pada laju reaksi.
Ketika energi kinetik rata-rata meningkat, partikel-partikel bergerak lebih cepat dan bertumbuhan lebih sering per satuan waktu dan memiliki energi yang lebih besar ketika mereka bertabrakan, kedua faktor ini meningkatkan laju reaksi.
Oleh karena itu laju reaksi hampir semua reaksi meningkat dengan meningkatnya suhu. Sebaliknya, laju reaksi dari hampir semua reaksi menurun dengan menurunnya suhu. Sebagai contoh, pendinginan memperlambat laju pertumbuhan bakteri dalam makanan dengan mengurangi laju reaksi dari reaksi biokimia yang memungkinkan bakteri bereproduksi.
Contoh suhu mempengaruhi laju reaksi, dalam sistem di mana lebih dari satu reaksi dimungkinkan, reaktan yang sama dapat menghasilkan produk yang berbeda dalam kondisi reaksi yang berbeda.
- Misalnya, dengan adanya asam sulfat encer dan pada suhu sekitar 100 ° C, etanol diubah menjadi dietil eter: 2CH3CH2OH−−−H2SO4 –>CH3CH2OCH2CH3+H2O
- Pada suhu 180 ° C, reaksi yang sangat berbeda terjadi, yang menghasilkan etilena sebagai produk utama: CH3CH2OH−- H2SO4–> C2H4 + H2O
Pengaruh Fase dan Luas Permukaan
Fase atau keadaan zat dan luas permukaan juga mempengaruhi besar laju reaksi. Laju reaksi akan berbeda ketika dua reaktan berada dalam fase cairan yang sama, partikel-partikelnya bertumbukan lebih sering daripada ketika satu atau kedua reaktan adalah padatan (atau ketika mereka berada dalam cairan berbeda yang tidak bercampur).
Jika reaktan terdistribusi secara seragam dalam larutan homogen tunggal, maka laju reaksi tergantung pada konsentrasi dan suhu, seperti yang baru saja kita lihat. Namun, jika reaksinya heterogen, reaktan berada dalam dua fase yang berbeda, dan tabrakan antara reaktan hanya dapat terjadi pada antarmuka antar fase, ini secara substansial menurunkan laju reaksi.
Laju reaksi dari reaksi heterogen tergantung pada luas permukaan fase yang lebih terkondensasi.
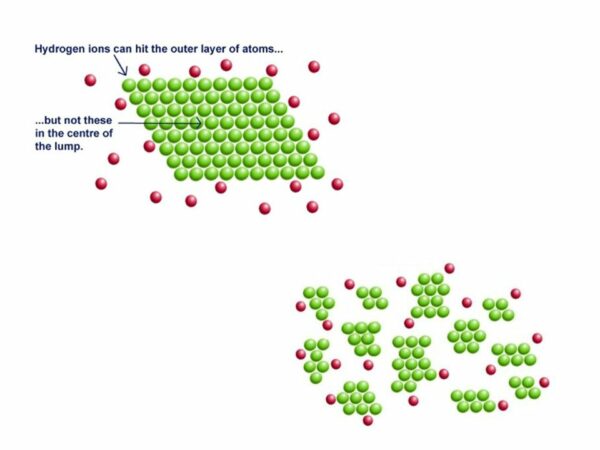
Sebagai contoh luas permukaan mempengaruhi laju reaksi bisa diamati pada kendaraan yang kita pakai. Mesin mobil menggunakan efek luas permukaan untuk meningkatkan laju reaksi. Bensin disuntikkan ke setiap silinder dalam bentuk tetesan mikroskopis karena yang akan menambah luas permukaan sehingga meningkatkan laju reaksi.
Pengaruh pelarut
Sifat pelarut juga dapat mempengaruhi laju reaksi partikel terlarut. Misalnya, laju reaksi larutan natrium asetat bereaksi dengan metil iodida dalam reaksi pertukaran untuk menghasilkan metil asetat dan natrium iodida akan menghasilkan laju reaksi yang kecil.
CH3CO2Na (soln) + CH3I (l) → CH3CO2CH3 (soln) + NaI (soln)
Reaksi ini terjadi 10 juta kali lebih cepat laju reaksinya dalam pelarut organik dimetilformamida [DMF; (CH3) 2NCHO] daripada dalam metanol (CH3OH). Meskipun keduanya adalah pelarut organik dengan konstanta dielektrik yang sama (36,7 untuk DMF dibandingkan 32,6 untuk metanol), metanol mampu mengikat hidrogen dengan ion asetat, sedangkan DMF tidak bisa, hidrogen mengurangi reaktivitas atom oksigen dalam ion asetat sehingga memperlambat laju reaksi.
Viskositas pelarut juga penting dalam menentukan laju reaksi. Dalam pelarut yang sangat kental, partikel terlarut berdifusi jauh lebih lambat daripada dalam pelarut yang kurang kental dan dapat bertumbukan lebih jarang per unit waktu sehingga berkurang laju reaksinya. Dengan demikian laju reaksi dari sebagian besar reaksi menurun dengan cepat dengan meningkatnya viskositas pelarut.
Pengaruh Katalis
Katalis adalah zat yang berpartisipasi dalam reaksi kimia dan meningkatkan laju reaksi tanpa mengalami perubahan kimia bersih itu sendiri. Perhatikan, misalnya, dekomposisi hidrogen peroksida dengan adanya dan tidak adanya katalis yang berbeda mempengaruhi laju reaksi. Karena kebanyakan katalis sangat selektif, mereka sering menentukan produk dari suatu reaksi dengan mempercepat laju reaksi hanya satu dari beberapa kemungkinan reaksi yang dapat terjadi.
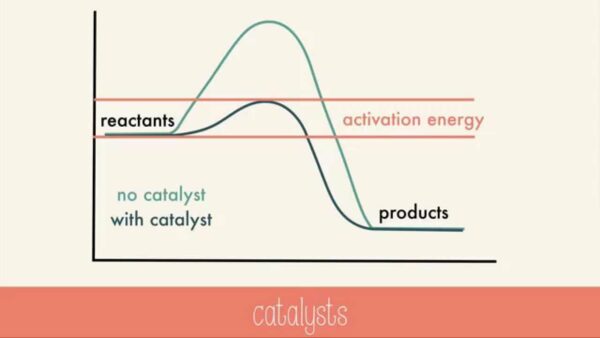
Sebagian besar bahan kimia massal yang diproduksi di industri dibentuk dengan reaksi katalis untuk mempercepat laju reaksi.