Ikatan peptida adalah jenis ikatan kimia yang terbentuk antara asam amino dalam pembentukan rantai peptida atau protein. Ikatan peptida terjadi melalui reaksi kondensasi antara gugus amino (-NH2) pada satu asam amino dengan gugus karboksilat (-COOH) pada asam amino lainnya. Reaksi ini menghasilkan gugus amida (-CONH-) yang membentuk ikatan kovalen.
Proses pembentukan ikatan peptida melibatkan penghilangan satu molekul air (H2O), yang disebut dehidrasi atau reaksi kondensasi. Gugus amino dari satu asam amino melepaskan atom hidrogen (H) dari gugus amino (-NH2), sementara gugus karboksilat dari asam amino lainnya melepaskan gugus hidroksil (OH) dari gugus karboksilat (-COOH). Atom hidrogen dan gugus hidroksil ini bergabung membentuk molekul air.
Contoh sederhana ikatan peptida adalah pembentukan dipeptida, yang melibatkan dua asam amino yang diikat bersama oleh ikatan peptida. Misalnya, ikatan peptida terbentuk saat gugus amino (-NH2) dari satu asam amino bergabung dengan gugus karboksilat (-COOH) dari asam amino lainnya, menghasilkan ikatan peptida dengan pelepasan satu molekul air.
Ikatan peptida dalam rantai peptida atau protein dapat membentuk struktur sekunder, seperti heliks alfa dan lembaran beta, serta struktur tersier dan kuartener yang lebih kompleks. Ikatan peptida memberikan kekuatan dan kestabilan pada protein, memainkan peran penting dalam fungsi biologis dan struktural mereka.
Ciri ikatan peptida
Pada tahun 1940-an dan 1950-an, penelitian berdasarkan difraksi sinar-X pada sampel kristal asam amino, dipeptida dan tripeptida yang dilakukan oleh Linus Pauling dan Robert Corey membantu memahami struktur ikatan peptida, mengamati bahwa:
- Ikatan C-N yang menghubungkan dua asam amino lebih pendek daripada ikatan C-N lainnya
- Ikatan C-N memiliki karakter ikatan rangkap sebagian karena distabilkan oleh resonansi, yang tidak memungkinkan rotasi dalam ikatan tersebut.
- Keempat atom ikatan (CO-NH) berada di bidang yang sama, dengan Oksigen dan Hidrogen pada posisi trans. Namun, sisa tautan (N-C dan C-C) adalah tautan tunggal sejati, sehingga mungkin ada putaran.
Pengaturan planar yang kaku ini adalah hasil dari stabilisasi resonansi ikatan peptida. Oleh karena itu, kerangka peptida terdiri dari serangkaian bidang berturut-turut yang dipisahkan oleh kelompok metilen tersubstitusi di mana mungkin ada belokan. Tetapi tidak semua belokan dimungkinkan, yang menempatkan pembatasan signifikan pada jumlah konformasi yang memungkinkan protein dapat adopsi.
Jika kita menyebut “Φ” nilai sudut yang dapat diambil oleh tautan N-C, dan “Ψ” dari tautan C-C, hanya akan ada beberapa nilai yang diizinkan untuk Φ dan Ψ; dan akan sangat tergantung pada ukuran dan karakteristik gugus R berturut-turut.
Pembentukan Ikatan Peptida
Reaksi pembentukan ikatan peptida antar asam amino dalam protein yang terjadi merupakan reaksi kondensasi, yang ditandai dengan lepasnya molekul air ketika reaksi berlangsung. Hasil dari ikatan ini merupakan ikatan CO-NH, dan menghasilkan molekul yang disebut amida.
Semua protein terbuat dari rantai asam amino ikatan yang bersama-sama dalam cara yang sangat spesifik. Sebagian besar asam amino memiliki gugus karboksil tunggal (-COOH) di satu sisi dan gugus amino (NH2-) di sisi lain. Asam amino yang berdekatan dapat membentuk ikatan peptida ketika satu kelompok asam karboksil yang bergabung dengan gugus amino yang lain.
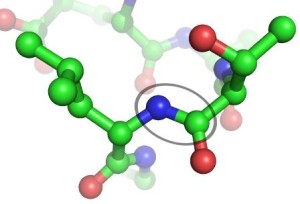
Ketika ikatan peptida terbentuk antara asam amino, molekul air hilang. Jenis reaksi ini disebut reaksi kondensasi. Molekul air (H2O) yang dibuat oleh hilangnya hidroksil (OH-) dari gugus karboksil dan atom hidrogen (H) dari gugus amino. Fakta bahwa semua asam amino ikatan bersama-sama dengan cara ini adalah salah satu faktor yang menentukan bentuk protein yang dibuat.
Ikatan peptida tunggal terjadi antara masing-masing pasangan asam amino. Protein juga disebut polipeptida seperti yang sering terdiri dari puluhan bahkan ratusan asam amino yang telah bergabung bersama menjadi rantai peptida. Ini berarti bahwa protein mengandung banyak ikatan peptida.
Contoh ikatan peptida:
![]()
Cara Memutus Ikatan Peptida
Ikatan peptida dapat dirusak atau diputus dengan melakukan hidrolisis. Ikatan peptida terbentuk dari protein yang mempunyai kecenderungan untuk putus secara spontan ketika terdapat air.
Dari hasil pemutusan tersebut, dilepaskan energi sebesar 10 kJ/mol. Namun, proses pemutusan terjadi sangat lambat. Pada umumnya, organisme menggunakan enzim untuk membantu proses pemutusan atau pembentukan ikatan peptida untuk mempercepat reaksi.
Untuk memecahkan ikatan peptida, reaksi hidrolisis – kebalikan dari reaksi kondensasi – harus terjadi. Reaksi hidrolisis terjadi ketika membelah protein menjadi rantai peptida, atau peptida menjadi asam amino tunggal.
Dalam hidrolisis, molekul air ditambahkan ke ikatan peptida, menyebabkan air untuk membagi. Gugus hidroksil (OH-) menempel pada gugus karboksil satu asam amino, dan atom hidrogen (H) menempel pada gugus amino yang lain.
Ikatan peptida dapat dipatahkan oleh hidrolisis (dengan menambahkan air). Dengan kehadirannya, ia akan membebaskan 8–16 kilojoule / mol (2-4 kkal / mol) energi bebas. Secara alami proses ini sangat lambat (lebih dari 1000 tahun), tetapi ada beberapa cara untuk mempercepatnya:
- Hidrolisis asam: Didasarkan pada perebusan protein yang berkepanjangan dengan larutan asam kuat (HCl dan H2SO4). Metode ini sepenuhnya menghancurkan triptofan dan bagian dari serin dan treonin.
- Hidrolisis basa: Melanjutkan asam amino yang dihancurkan oleh hidrolisis sebelumnya. Biasanya NaOH atau Ba (OH) 2 digunakan.
- Hidrolisis enzimatik: Ini adalah bentuk paling umum pada makhluk hidup, enzim proteolitik digunakan yang aktivitasnya lambat dan sering tidak lengkap, namun rasemisasi tidak terjadi dan asam amino tidak dihancurkan; oleh karena itu sangat spesifik. Enzim trypsin dan chymotrypsin, hadir dalam jus pencernaan, adalah contoh dari enzim proteolitik.
- Hidrolisis berdasarkan suhu: Catatan 1 dalam kondisi normal, suhu tinggi tidak merusak ikatan peptida, meskipun dapat mendenaturasi protein (pecahnya struktur sekunder, tersier dan kuaterner). Namun, suhu ekstrem yang diterapkan dalam waktu lama dapat merusak ikatan peptida (> 110 derajat 48 jam).
Asam Amino
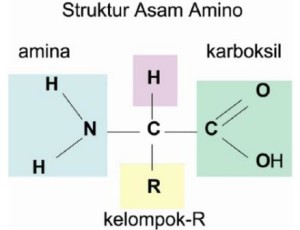
Asam amino adalah senyawa organik yang mengandung gugus amino (NH2), sebuah gugus asam karboksilat (COOH), dan salah satu gugus lainnya, terutama dari kelompok 20 senyawa yang memiliki rumus dasar COOH – R – NH2, dan dihubungkan bersama oleh ikatan peptida untuk membentuk protein.
Jenis asam amino dibedakan menjadi dua, yaitu asam amino essensial dan asam amino nonessensial. Asam amino essensial adalah jenis asam amino yang tidak dapat disintesis oleh tubuh, jadi untuk mendapatkannya kita harus memakan makanan dari hewan atau tumbuhan yang mengandung asam amino essensial tersebut. Sedangkan asam amino nonessensial adalah jenis asam amino yang dapat disintesis oleh tubuh. Jadi, tanpa memakan makanan yang mengandung asam amino nonessensial tersebut, tubuh dapat mensistesisnya sendiri. Asam amino essensial terdiri dari 10 asam amino.
Protein
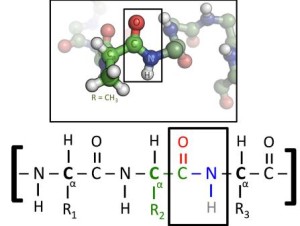
Protein merupakan polimer yang tersusun dari asam amino sebagai monomernya. Monomer-monomer ini tersambung dengan ikatan peptida, yang mengikat gugus karboksil milik satu monomer dengan gugus amina milik monomer di sebelahnya.
Protein merupakan polimer dari asam amino dengan jumlah lebih dari 50 asam amino, kombinasi dari 10 atau lebih asam amino disebut polipeptida. Protein terbentuk dari sekitar 10 jenis asam amino.
Post terkait
Bagaimana ikatan peptida mempengaruhi kekuatan dan kestabilan struktur protein?
Apa perbedaan antara ikatan peptida dan ikatan kovalen lainnya?