Konfigurasi kulit elektron adalah salah satu notasi kuantum untuk jumlah elektron dan sublevels energi mereka disingkat dengan simbol gas mulia dalam tanda kurung. Ini sangat berguna saat menulis konfigurasi elektron untuk unsur tertentu, karena sederhana dan cepat.
Kata ‘kernel’ sering mengacu pada kulit elektron bagian dalam atom; artinya, elektron yang elektronnya tidak bervalensi dan karena itu tidak berpartisipasi dalam ikatan kimia , meskipun elektron menentukan sifat-sifat unsur. Secara metaforis, kernel akan menjadi bagian dalam bawang, dengan lapisannya terdiri dari serangkaian orbital yang meningkatkan energi.
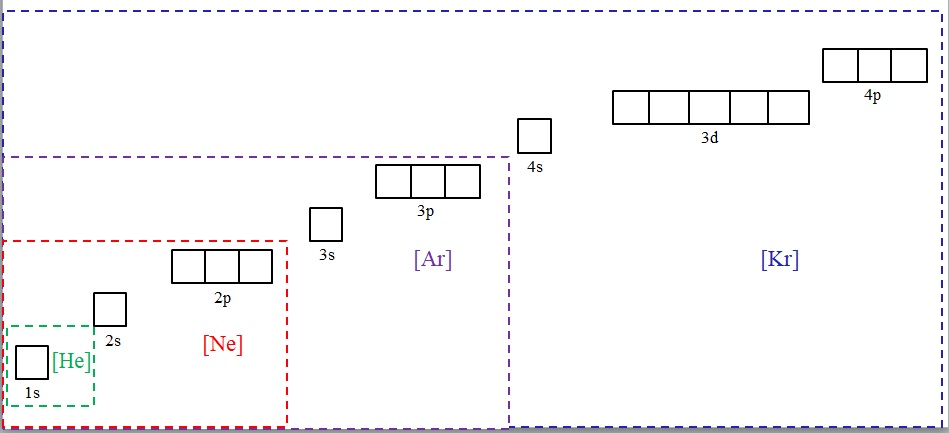
Konfigurasi elektron disingkat dengan simbol gas mulia. Sumber: Gabriel Bolivar.
Gambar di atas menunjukkan simbol kimia untuk empat gas mulia dalam kurung dan dengan warna yang berbeda: [He] (hijau), [Ne] (merah), [Ar] (ungu), dan [Kr] (biru).
Setiap bingkai putus-putusnya berisi kotak-kotak yang mewakili orbital. Semakin besar, semakin besar jumlah elektron yang dikandungnya; yang pada gilirannya akan berarti bahwa konfigurasi elektronik dari lebih banyak unsur dapat disederhanakan dengan simbol-simbol ini. Ini menghemat waktu dan energi menulis semua notasi.
Bangun pesanan
Sebelum menggunakan konfigurasi kulit elektron, ada baiknya untuk meninjau kembali urutan yang benar untuk membuat atau menulis konfigurasi tersebut. Ini diatur menurut aturan diagonal atau diagram Moeller (di beberapa bagian disebut metode hujan). Dengan diagram ini, notasi kuantum adalah sebagai berikut:
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d 7p
Rangkaian notasi kuantum ini terlihat berat; dan akan lebih baik lagi jika harus ditulis setiap kali konfigurasi elektron dari setiap unsur yang ditemukan pada periode 5 dan seterusnya akan direpresentasikan. Perhatikan juga bahwa string kosong dari elektron; tidak ada bilangan di sudut kanan atas (1s 2 2s 2 2p 6 …).
Harus diingat bahwa orbital s dapat “menampung” dua elektron (ns 2 ). Orbital p berjumlah tiga (lihat tiga kotak di atas), sehingga dapat menampung enam elektron (np 6 ). Dan akhirnya, orbital d adalah lima, dan f tujuh, masing-masing memiliki total sepuluh (nd 10 ) dan empat belas (nf 14 ) elektron.
Singkatan konfigurasi elektron
Karena itu, kita melanjutkan untuk mengisi baris notasi kuantum sebelumnya dengan elektron:
1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 14 6d 10 7p 6
Berapa jumlah elektron seluruhnya? 118. Dan dengan unsur mana jumlah elektron yang begitu besar sesuai dalam atomnya? Untuk oganeson gas mulia, Og.
Misalkan ada unsur dengan bilangan kuantum Z sama dengan 119. Maka konfigurasi elektron valensinya adalah 8s 1 ; tetapi bagaimana konfigurasi elektronik lengkapnya?
1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 14 6d 10 7p 6 8s 1
Dan seperti apa konfigurasi kulit elektron Anda, yang ringkas? Adalah:
[Og] 8s 1
Perhatikan penyederhanaan atau singkatan yang jelas. Dalam lambang [Og] semua 118 elektron yang ditulis di atas dihitung, jadi unsur yang tidak pasti ini memiliki 119 elektron, yang hanya satu yang bervalensi (akan terletak di bawah fransium dalam tabel periodik).
Contoh Konfigurasi kulit elektron
umum
Sekarang anggaplah Anda ingin membuat singkatan secara bertahap:
[He] 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 14 6d 10 7p 6
Perhatikan bahwa 1s 2 digantikan oleh [He]. Gas mulia berikutnya adalah neon, yang memiliki 10 elektron. Mengetahui hal ini, singkatannya berlanjut:
[Ne] 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 14 6d 10 7p 6
Kemudian argon mengikuti, dengan 18 elektron:
[Ar] 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 14 6d 10 7p 6
Karena gas mulia berikutnya adalah kripton, singkatan ini ditambah lagi dengan 36 elektron:
[Kr] 5d 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 14 6d 10 7p 6
Xenon memiliki 54 elektron, dan oleh karena itu kita pindahkan singkatannya ke orbital 5p:
[Xe] 6d 2 4f 14 5d 10 6p 6 7s 2 5f 14 6d 10 7p 6
Sekarang Anda akan memperhatikan bahwa konfigurasi elektron selalu disingkat menjadi orbital np; yaitu, gas mulia memiliki orbital yang diisi dengan elektron. Dan akhirnya radon mengikuti, dengan 86 elektron, jadi kita menyingkat orbital 6p:
[Rn] 7s 2 5f 14 6d 10 7p 6
Oksigen
Oksigen memiliki delapan elektron, konfigurasi elektronik lengkapnya adalah:
1s 2 2s 2 2p 4
Satu-satunya singkatan yang bisa kita gunakan adalah [He] untuk 1s 2 . Dengan demikian, konfigurasi kernel elektronik Anda menjadi:
[Dia] 2s 2 2p 4
Kalium
Kalium memiliki sembilan belas elektron, konfigurasi elektronik lengkapnya adalah:
1s 2 2s 2 2p 6 3s 2 3p 6 4s 1
Perhatikan bahwa kita dapat menggunakan simbol [He] untuk menyingkat konfigurasi ini; serta [Ne] dan [Ar]. Yang terakhir adalah yang digunakan karena argon adalah gas mulia yang paling dekat dengan kalium. Jadi konfigurasi elektron kernel Anda terlihat seperti:
[Ar] 4s 1
Indian
Indium memiliki empat puluh sembilan elektron, konfigurasi elektronik lengkapnya adalah:
1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 1
Karena kripton adalah gas mulia terdekat sebelum indium, simbol [Kr] digunakan untuk singkatannya, dan kita memiliki konfigurasi elektron inti:
[Kr] 5s 2 4d 10 5p 1
Meskipun orbital 4d tidak secara formal termasuk dalam inti indium, elektronnya tidak terlibat (setidaknya dalam kondisi normal) dalam ikatan logamnya, melainkan elektron dari orbital 5s dan 5p.
tungsten
Tungsten (atau wolfram) memiliki 74 elektron dan konfigurasi elektron lengkapnya adalah:
1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 4
Sekali lagi, kita mencari gas mulia terdekat yang mendahuluinya. Dalam kasus Anda, ini sesuai dengan xenon, yang memiliki orbital 5p lengkap. Jadi, kita mengganti string notasi kuantum untuk simbol [Xe], dan kita akhirnya akan memiliki konfigurasi elektron kernelnya:
[Xe] 6s 2 4f 14 5d 4
Referensi
- Menggigil & Atkins. (2008). Kimia Anorganik . (Edisi keempat). Bukit Mc Graw.
- Whitten, Davis, Peck & Stanley. (2008). Kimia . (edisi ke-8). CENGAGE Belajar.
- Pat Thayer. (2016). Diagram Konfigurasi Elektron. Dipulihkan dari: chemistryapp.org
- Helmenstine, Anne Marie, Ph.D. (5 Desember 2018). Definisi Inti Gas Mulia. Dipulihkan dari: thinkco.com/
- Wikipedia. (2019). Konfigurasi elektronik. Dipulihkan dari: es.wikipedia.org