Apa yang dimaksud dengan penyetaraan persamaan kimia?
Menyetarakan persamaan kimia adalah operasi matematika yang dilakukan untuk mempertahankan hukum kekekalan materi dalam reaksi. Materi tidak diciptakan atau dihancurkan. Oleh karena itu, jumlah atom sebelum dan sesudah reaksi kimia harus sama, baik dalam reaktan maupun produk.
Untuk menyetarakan persamaan kimia, Anda harus menghitung atom sebelum dan sesudah panah. Jika angkanya cocok, berarti reaksinya seimbang. Jika tidak, akan diperlukan untuk menyamakan angka-angka ini dengan memodifikasi koefisien stoikiometri melalui trial and error, ini menjadi metode yang paling sederhana dan paling intuitif untuk menyeimbangkan.
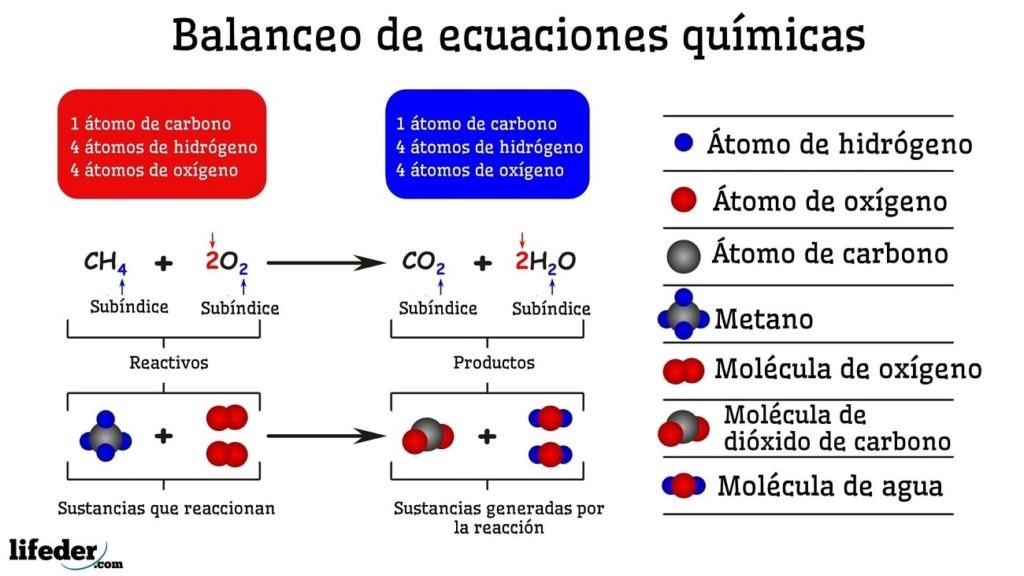
Contoh penyeimbangan kimia dari reaksi antara metana dan dua molekul oksigen
Ketika berayun dengan coba-coba, seolah-olah atom ditambahkan atau dihilangkan pada salah satu dari dua sisi jungkat-jungkit. Sampai jungkat-jungkit ditangguhkan secara horizontal, persamaan kimia tidak akan sepenuhnya seimbang. Tidak ada lagi (menciptakan materi) dan tidak ada lebih sedikit atom (menghancurkan materi) di kedua sisi.
Contoh Persamaan Persamaan Mudah
Contoh berikut akan menunjukkan persamaan kimia yang seimbang atau mudah disetarakan. Semua pasti memiliki kesamaan bahwa jumlah atom, untuk setiap unsur, akan sama sebelum dan sesudah panah setelah persamaan kimia disetarakan.
Oksidasi merkuri
2HG + O 2 → Hg 2 O 2
Kita memiliki dua elemen: merkuri (Hg) dan oksigen (O). Kita menyatakan jumlah atomnya sebelum (reaktan) dan setelah (produk) panah:
Hg: 2 (kiri) – 2 (kanan)
O: 2 (kiri) – 2 (kanan)
Persamaan seimbang karena atom Hg dan O sama pada kedua sisi panah.
Pembakaran hidrogen
H 2 + O 2 → H 2 O
Kita kembali memiliki dua elemen: hidrogen (H) dan oksigen (O). Mengulangi langkah sebelumnya:
H: 2 – 2
O: 2 – 1
Ada satu oksigen yang tersisa di sisi kiri daripada di kanan. Karena itu kita harus menambahkan oksigen lain ke kanan. Untuk melakukan ini, kita memodifikasi koefisien stoikiometrik, yang merupakan angka yang menyertai dan mendahului rumus. Jika kita menempatkan 2 di depan H 2 O itu akan memberi kita:
H 2 + O 2 → 2H 2 O
H: 2 – 4
O: 2 – 2
Oksigennya seimbang. Tapi tidak dengan hidrogen. Anda harus menambahkan dua hidrogen sekarang di sebelah kiri:
2H 2 + O 2 → 2H 2 O
H: 4 – 4
O: 2 – 2
Dan persamaan akhirnya seimbang: jumlah H dan O yang sama sebelum dan sesudah panah.
Perhatikan bahwa koefisien stoikiometrik (2 untuk H 2 dan 1 untuk O 2 ) mengalikan subskrip dari rumus. Perkalian ini akan memberi kita jumlah total atom untuk unsur tertentu.
Reduksi magnesium
Mg (NO 3 ) 2 + 2Li → Mg + 2LiNO 3
Kita mengevaluasi jumlah atom untuk setiap elemen:
mg: 1 – 1
Li: 2 – 2
N: 2 – 2
Atau: 6 – 6
Persamaan kimia sudah seimbang dan tidak perlu disetarakan.
Latihan yang diselesaikan
Sebelum melanjutkan untuk menyetarakan persamaan apa pun, selalu perlu untuk memastikan apakah persamaan tersebut belum seimbang. Yang mengatakan, kita melanjutkan dengan latihan berikut:
Latihan 1
Seimbang atau tidak?
Fe 2 O 3 + H 2 O → Fe (OH) 3
Kita memiliki tiga elemen: besi (Fe), hidrogen dan oksigen. Salah satu saran ketika menyetarakan persamaan adalah mulai dengan menghitung jumlah atom dari unsur yang paling sedikit jumlahnya dalam persamaan; yang umumnya berbeda dengan H dan O. Jadi, pertama-tama kita hitung atom Fe:
Fe: 2 – 1
Subskrip 3 dari (OH) 3 tidak mengalikan Fe di sebelah kiri. Untuk H dan O kita memiliki:
H: 2 – 3
Atau: 4 – 3
Semua unsur tidak seimbang.
Bahkan sebelum menyetarakan H dan O, kita harus menyetarakan atom Fe: unsur yang paling sedikit jumlahnya, karena hampir tidak ada 3 Fe, tidak seperti 5 H dan 7 O. Maka, kita harus menambahkan satu Fe ke kanan:
Fe: 2 – 2
Yang sama dengan menempatkan 2 sebagai koefisien stoikiometri di depan Fe (OH) 3 . Persamaannya akan menjadi:
Fe 2 O 3 + H 2 O → 2Fe (OH) 3
Fe: 2 – 2
H: 2 – 6
Atau: 4 – 6
Tapi H dan O tetap tidak seimbang. Sebuah H 2 O menyumbang 2 H dan kita memiliki 4 H lagi. Oleh karena itu, kita akan menambahkan dua H 2 O sehingga kita memiliki tiga H 2 O:
Fe 2 O 3 + 3H 2 O → 2Fe (OH) 3
Dan kita evaluasi lagi:
Fe: 2 – 2
H: 6 – 6
Atau: 6 – 6
Perhatikan bagaimana O seimbang dengan sendirinya setelah kita menyetarakan H. Persamaan akhirnya seimbang.
Latihan 2
Seimbang atau tidak?
CH 4 + O 2 → CO 2 + H 2 O
Kita mengevaluasi jumlah atom untuk semua unsur yang ada:
C: 1 – 1
H: 4 – 2
Atau: 2 – 3
Karbon seimbang, tetapi hal yang sama tidak berlaku untuk hidrogen dan oksigen. Persamaannya tidak seimbang.
Karena C seimbang, kita tidak ingin mengubah koefisien stoikiometri CH 4 atau CO 2 . Setidaknya tidak pada prinsipnya.
Kita memusatkan perhatian kita pada H dan O, terutama H. Mengapa? Karena melihat persamaan lebih mudah untuk menyetarakan H sebelum O. Oleh karena itu, kita perlu menambahkan 2 H ke kanan, menempatkan koefisien 2 di depan H 2 O:
CH 4 + O 2 → CO 2 + 2H 2 O
C: 1 – 1
H: 4 – 4
Atau: 2 – 4
C dan H seimbang. Kita memiliki 2 O tersisa. Jika setiap O 2 menyumbang 2 O, maka kita akan menambahkan tambahan O 2 sehingga menjadi 4 O ke kiri. Ini sama dengan menempatkan koefisien 2 di depan O 2 :
CH 4 + 2O 2 → CO 2 + 2H 2 O
C: 1 – 1
H: 4 – 4
O: 4 – 4
Dan persamaan akhirnya seimbang.
Latihan 3
Seimbang atau tidak?
N 2 + H 2 → NH 3
Kita mengevaluasi dua unsur kita N dan H:
N: 2 – 1
H: 2 – 3
Persamaan tidak seimbang.
Kita mulai dengan N yang seimbang, unsur selain H. Kita kekurangan satu N di sebelah kanan, dan karena setiap NH 3 menyumbang 1 N, kita harus menambahkan NH 3 lagi untuk mendapatkan 2 N:
N 2 + H 2 → 2NH 3
N: 2 – 2
H: 2 – 6
Dan sekarang kita kehilangan H di sebelah kiri. Jika setiap H 2 menyumbang 2 H ke persamaan, maka kita harus menambahkan dua lagi sehingga ada 6 H. Ini sama dengan menempatkan koefisien stoikiometrik 3 di depan H 2 :
N 2 + 3H 2 → 2NH 3
N: 2 – 2
H: 6 – 6
Dan persamaan kimia akhirnya seimbang.
Referensi
- Whitten, Davis, Peck & Stanley. (2008). Kimia . (edisi ke-8). CENGAGE Belajar.
- LibreText Kimia. (23 November 2020). Bagaimana Menulis Persamaan Kimia Setara. Dipulihkan dari: chem.libretexts.org
- Wikipedia. (2020). Persamaan kimia. Dipulihkan dari: en.wikipedia.org
- Prinsip Kimia. (sf). Menulis dan Menyeimbangkan Persamaan Kimia. [PDF]. Dipulihkan dari: web.ung.edu
- Phet. (sf). Menyetarakan persamaan kimia. Dipulihkan dari: phet.colorado.edu
- Armando Marín B. (nd). Kimia umum: Persamaan keseimbangan. [PDF]. Dipulihkan dari: depa.fquim.unam.mx