Radikal alkil adalah seperangkat molekul tidak stabil yang dihasilkan dari hilangnya hidrogen dari alkana. Mereka dicirikan oleh memiliki elektron yang tidak berpasangan, sehingga mereka bereaksi dengan cepat untuk melengkapi oktet valensi atom tempat ia berada.
Radikal-radikal ini dilambangkan dengan huruf R, seperti gugus alkil, tetapi dengan perbedaan bahwa titik ditambahkan, R ·. Titik ini menunjukkan adanya elektron yang tidak berpasangan. Sebagai contoh, perhatikan gas metana, CH 4 . Alkana ini, setelah kehilangan salah satu hidrogennya, akan berubah menjadi radikal metil, CH 3 · (gambar di bawah).
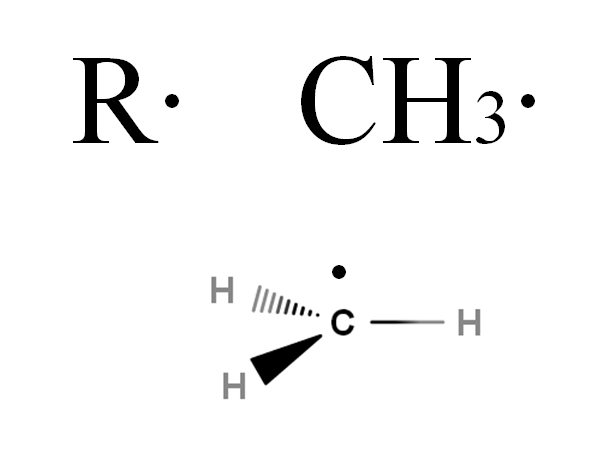
Rumus umum radikal alkil dan radikal metil. Sumber: Gabriel Bolívar melalui MolView.
Jika Anda ingin masuk lebih dalam ke struktur radikal CH 3 ·, Anda akan melihat bahwa elektronnya yang tidak berpasangan berada pada sudut tegak lurus terhadap ikatan CH; yaitu, terletak di orbital p murni. Oleh karena itu, CH 3 · mengadopsi hibridisasi sp 2 , seperti yang umumnya terjadi dengan radikal alkil lainnya.
Radikal ini adalah landasan reaksi berantai di mana alkana berpartisipasi, seperti halogenasinya: klorinasi, brominasi, dll. Ada radikal ke-1, ke-2 dan ke-3, serta vinil dan alilik, masing-masing dengan stabilitas dan kemudahan pembentukannya masing-masing.
Bagaimana radikal alkil terbentuk?
Reaksi “paling sederhana” dimana radikal alkil terbentuk adalah halogenasi alkana. Agar mereka terbentuk, reaksi berantai harus terjadi, yang hanya terjadi pada suhu tinggi (di atas 250 C), atau di bawah sinar ultraviolet pada suhu kamar.
Pertimbangkan klorinasi metana di bawah salah satu kondisi yang disebutkan di atas:
Cl 2 → 2Cl
Energi yang diberikan cukup untuk memutuskan ikatan Cl-Cl dari molekul klorin, menyebabkan pemutusan homolitik; yaitu, setiap atom klorin menyimpan salah satu elektron dalam ikatan. Oleh karena itu, dua Cl · radikal terbentuk.
Kemudian radikal Cl menyerang molekul metana:
Cl · + CH 4 → HCl + CH 3 ·
Dan radikal metil muncul. CH 3 · ini cukup tidak stabil, sehingga akan segera bereaksi untuk mendapatkan elektron tambahan yang akan berpasangan dengan elektron tunggalnya:
CH 3 + Cl 2 → CH 3 Cl + Cl
Cl · yang terbentuk akan bereaksi dengan molekul metana lain dan siklus tersebut akan berulang terus menerus. Saat metana habis, reaksi berikut akan terjadi, mengakhiri reaksi berantai:
Cl + Cl → Cl 2
CH 3 + CH 3 → CH 3 CH 3
CH 3 + Cl → CH 3 Cl
Stabilitas Relatif
CH 3
Metana bukan satu-satunya alkana yang “diradikalisasi” dengan klorinasi. Hal yang sama berlaku untuk etana, propana, butana, dan isomer lainnya. Namun, yang berbeda adalah energi yang diperlukan yang harus disediakan oleh radikal Cl · untuk mendehidrogenasi molekul alkana. Dalam kasus radikal metil, sangat tidak stabil dan karena itu sulit untuk dibentuk.
Dengan demikian, radikal CH 3 CH 2 · lebih stabil dan lebih mudah terbentuk daripada CH 3 ·. Mengapa? Karena radikal CH 3 CH 2 · adalah primer, 1º, yang berarti elektron tidak berpasangan berada pada atom karbon yang terikat pada karbon lain. Sedangkan CH 3 · tidak ada lagi yang terikat pada atom hidrogen.
Tentang apakah ini? Mengingat representasi sebelumnya, elektron tidak berpasangan terletak di orbital p , tegak lurus terhadap ikatan lainnya. Dalam CH 3 ·, atom hidrogen hampir tidak menyumbangkan kerapatan elektron ke atom karbon, dalam upaya untuk mengkompensasi kekurangan elektron lain.
1
Dalam CH 3 CH 2 ·, di sisi lain, karbon dengan elektron tidak berpasangan terkait dengan dua hidrogen dan gugus metil. Akibatnya, karbon ini menerima kerapatan elektron yang lebih tinggi, yang membantu menstabilkan elektron yang tidak berpasangan sedikit. Penjelasan yang sama berlaku untuk radikal alkil pertama lainnya.
ke-2
Dalam radikal alkil sekunder atau ke-2, seperti radikal isopropil, (CH 3 ) 2 C ·, elektron yang tidak berpasangan bahkan lebih stabil karena sekarang menerima kerapatan elektronik dari dua gugus karbon. Oleh karena itu, ia lebih stabil daripada radikal pertama dan metil.
3
Kita juga memiliki radikal alkil tersier atau ke-3, seperti radikal ters-butil, (CH 3 ) 3 C ·. Ini lebih stabil daripada yang pertama dan kedua. Sekarang, tiga gugus karbon berbeda dari atom hidrogen yang menstabilkan elektron yang tidak berpasangan.
Allil dan vinil
Perlu juga disebutkan radikal alil, CH 2 = CH-CH 2 ·, dan vinil, CH 2 = CH ·.
Allylic adalah yang paling stabil. Ini karena elektron yang tidak berpasangan bahkan mampu pindah ke atom karbon di ujung yang lain. Vinylic, di sisi lain, adalah yang paling tidak stabil, karena CH 2 = kelompok, lebih asam, menarik kerapatan elektronik ke arah dirinya sendiri alih-alih menyumbangkannya ke karbon dengan elektron yang tidak berpasangan.
Singkatnya, stabilitas relatif radikal alkil, dari tertinggi ke terendah, adalah:
Allyl> 3> 2> 1> vinil
Tata nama
Tatanama radikal alkil sama dengan gugus alkil: akhiran -ano, atas nama alkana, diubah menjadi akhiran -il. Jadi, CH 3 CH 2 · disebut radikal etil; dan radikal CH 3 CH 2 CH 2 CH 3 , n -butil.
Radikal alkil utama
Radikal alkil utama bertepatan dengan gugus alkil: mereka adalah mereka yang memiliki kurang dari enam atom karbon. Oleh karena itu, radikal alkil yang berasal dari metana, etana, propana, butana, dan pentana adalah yang paling umum. Juga, vinil dan radikal alilik adalah bagian dari daftar ini.
Radikal alkil lain yang lebih jarang ditemui adalah yang berasal dari sikloalkana, seperti siklopropil, siklobutana, atau siklopentana.
Pada gambar berikut beberapa radikal ini diwakili dengan huruf yang ditetapkan:
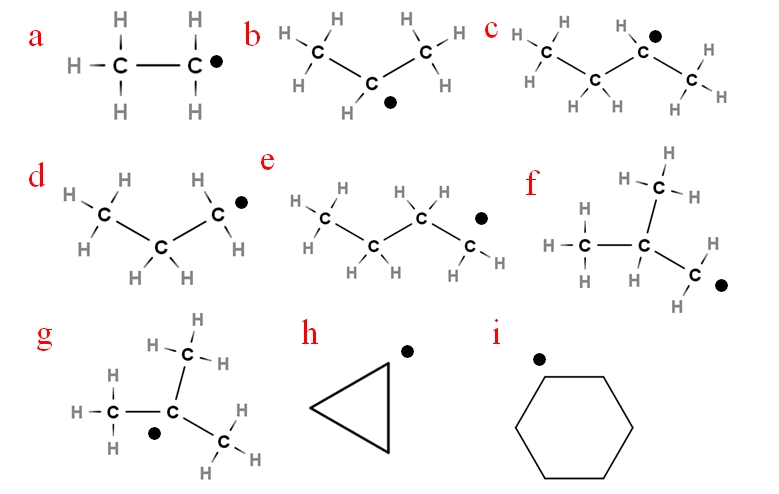
Sembilan dari radikal alkil yang paling penting. Sumber: Gabriel Bolivar.
Dimulai dengan huruf ‘a’, kita memiliki:
-a, etil radikal
-b, radikal isopropil
-c, sek-butil radikal
-d, propil radikal
-e, n -butil radikal
-f, radikal isobutil
-g, radikal tert-butil
-h, radikal siklopropil
-i, radikal sikloheksil
Masing-masing radikal ini mungkin atau mungkin tidak memiliki hidrogennya disubstitusi oleh kelompok lain, itulah sebabnya mereka sama bervariasinya dengan alkana dan isomer strukturalnya.
Referensi
- Morrison, RT dan Boyd, R, N. (1987). Kimia Organik . Edisi ke-5. Editorial Addison-Wesley Interamericana.
- Carey F. (2008). Kimia Organik . (Edisi keenam). Bukit Mc Graw.
- Graham Solomons TW, Craig B. Fryhle. (2011). Kimia Organik . (edisi ke-10.). Wiley Plus.
- Wikipedia. (2020). Alkil. Dipulihkan dari: en.wikipedia.org
- LibreText Kimia. (05 Juni 2019). Struktur Radikal Alkil: Hiperkonjugasi. Dipulihkan dari: chem.libretexts.org