Alkena atau olefin yang hidrokarbon tak jenuh yang memiliki setidaknya satu ikatan ganda dalam strukturnya. Mereka disebut olefin karena kemampuan etena atau etilen untuk bereaksi dengan halogen untuk menghasilkan minyak atau minyak. Saat ini istilah ini tidak lagi digunakan dan senyawa ini biasanya disebut sebagai alkena.
Sifat fisik alkena dipengaruhi oleh berat molekulnya, serta kerangka karbonnya. Misalnya, alkena dengan 2 sampai 4 karbon (etena menjadi butena) adalah gas. Dengan 5 sampai 18 atom karbon dalam rantai panjang mereka cair. Sedangkan alkena dengan lebih dari 18 atom karbon bersifat padat.
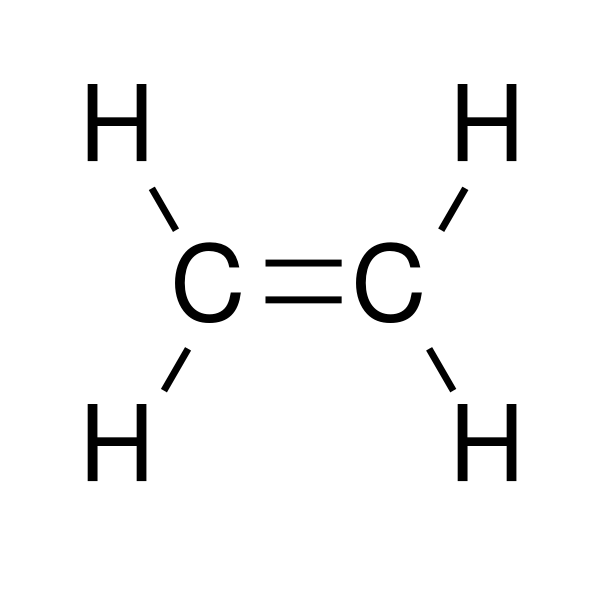
etena Oleh Pengguna: Bryan Derksen [Domain publik], dari Wikimedia Commons
Kehadiran ikatan rangkap memberi mereka reaktivitas yang besar, sehingga mengalami banyak reaksi kimia, seperti penambahan, eliminasi, hidrogenasi, hidrasi dan polimerisasi, yang memungkinkannya menghasilkan banyak kegunaan dan kegunaan.
Alkena diproduksi secara industri dengan perengkahan termal alkana dengan berat molekul tinggi (lilin parafin); Dehidrogenasi katalitik dan klorinasi-dehidroklorinasi.
Struktur kimia
Sumber sendiri
Alkena dicirikan dengan memiliki satu atau lebih ikatan rangkap dalam strukturnya. Ini direpresentasikan sebagai C = C, kedua atom karbon memiliki hibridisasi sp 2 .
Oleh karena itu, daerah rantai di mana ikatan rangkap, atau ketidakjenuhan, adalah datar. Perlu juga dicatat bahwa dua karbon dapat dihubungkan dengan dua substituen (atau gugus) lainnya.
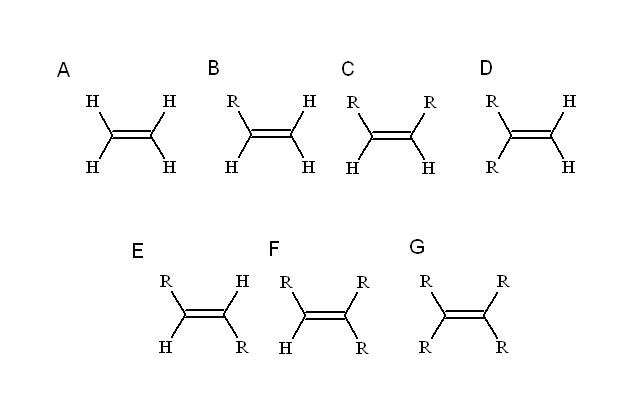
Substituen apa? Siapapun yang menggantikan salah satu hidrogen alkena yang paling sederhana: etilen (atau etena). Mulai dari itu (A, gambar atas) R, yang merupakan substituen alkil, menggantikan salah satu dari empat hidrogen untuk menghasilkan alkena tersubstitusi-mono (B).
Sejauh ini, terlepas dari hidrogen yang tersubstitusi, identitas B tidak berubah, artinya ia tidak memiliki stereoisomer, senyawa dengan rumus kimia yang sama tetapi dengan susunan atom yang berbeda.
Stereoisomer
Ketika hidrogen kedua digantikan oleh R lain, seperti pada C, sekarang stereoisomer C, D dan E muncul. Ini karena orientasi spasial terhadap kedua R dapat bervariasi, dan untuk membedakan satu dari yang lain kita menggunakan cis -trans atau EZ tugas.
Dalam C, alkena disubstitusi, dua R dapat berupa rantai dengan panjang berapa pun atau beberapa heteroatom. Yang satu dalam posisi frontal dalam hubungannya dengan yang lain. Jika dua Rs terdiri dari substituen yang sama, F, misalnya, maka C adalah cis-stereoisomer.
Di D, kedua gugus R bahkan lebih dekat, karena mereka terikat pada atom karbon yang sama. Ini adalah stereoisomer geminal, meskipun lebih dari stereoisomer, ini sebenarnya adalah ikatan rangkap terminal, yaitu pada akhir atau awal rantai (untuk alasan itu karbon lainnya memiliki dua hidrogen).
Dan di E, stereoisomer (atau isomer geometris) yang paling stabil, kedua gugus R dipisahkan oleh jarak yang lebih jauh, yang melintasi diagonal ikatan rangkap. Kenapa paling stabil? Karena semakin besar pemisahan spasial di antara mereka, maka tidak ada ketegangan sterik di antara mereka.
Di sisi lain F dan G masing-masing adalah alkena tersubstitusi tri dan tetra. Sekali lagi, mereka tidak mampu menghasilkan stereoisomer.
Sifat fisik dan kimia
Kelarutan
Mereka tidak dapat bercampur dengan air karena polaritasnya yang rendah. Tapi mereka larut dalam pelarut organik.
Titik lebur dalam C
Etena -169, Propena -185, 1-Pentena -165, 1-Heptena -119, 3-Okten
-101,9, 3-nonana -81,4 dan 5-desen -66,3.
Titik didih dalam ° C
Etena -104, propena -47, trans2butena 0,9, cis2butena 3,7, 1-pentena 30, 1-heptena 115, 3-oktena 122, 3-nonena 147 dan 5-desen 170.
Kenaikan titik didih berbanding lurus dengan jumlah karbon alkena. Sebaliknya, semakin bercabang strukturnya, semakin lemah interaksi antarmolekulnya, yang tercermin dari penurunan titik didih atau titik lelehnya.
Kepadatan
Etena 0,6128 mg/ml, propena 0,6142 mg/ml dan 1-butena 0,6356 mg/ml, 1-pentena 0,64 mg/ml dan 1-heksena 0,673.
Dalam alkena kepadatan maksimum adalah 0,80 mg / ml. Artinya, mereka kurang padat daripada air.
Polaritas
Itu tergantung pada struktur kimia, substitusi dan keberadaan gugus fungsi lainnya. Alkena memiliki momen dipol yang rendah, sehingga isomer cis dari 2-butena memiliki momen dipol 0,33, sedangkan isomer transnya memiliki momen dipol nol.
Reaktivitas
Alkena memiliki kapasitas yang besar untuk bereaksi karena ikatan rangkap yang mereka miliki. Di antara reaksi di mana mereka mengambil bagian adalah: adisi, eliminasi, substitusi, hidrogenasi, hidrasi dan polimerisasi.
Reaksi Penambahan
H 2 C = CH 2 + Cl 2 => ClCH 2 -CClH 2 (etilen diklorida)
Reaksi Hidrogenasi
Terjadi pada suhu tinggi dan dengan adanya katalis yang sesuai (Pt, Pd, Ni yang terbagi halus)
CH 2 = CH 2 + H 2 => CH 3 -CH 3 (etana)
Reaksi Hidrasi
Reaksi yang menjadi sumber pembentukan alkohol dari turunan minyak bumi :
H 2 C = CH 2 + H 2 O => H 3 C-CH 2 OH (etil alkohol)
Reaksi Polimerisasi
Etilen dengan adanya katalis seperti aluminium trialkil dan titanium tetraklorida berpolimerisasi dalam polietilen, yang mengandung sekitar 800 atom karbon. Jenis polimer ini disebut polimer adisi.
Penggunaan dan Aplikasi
Polimer
-Polietilen densitas rendah digunakan dalam pembuatan tas, plastik rumah kaca, wadah, piring, gelas, dll. Sedangkan kepadatan tinggi lebih kaku dan tahan mekanis, digunakan dalam pembuatan kotak, furnitur, pelindung seperti helm dan bantalan lutut, mainan dan palet.
-Polypropylene, polimer propilena, digunakan dalam pembuatan wadah, lembaran, peralatan laboratorium, mainan, film kemasan, filamen untuk tali, pelapis dan karpet.
-Polyvinyl chloride (PVC) adalah polimer dari vinil klorida yang digunakan dalam pembuatan pipa, ubin lantai, saluran, dll.
-Polibutadiena, polimer 1,3-butadiena, digunakan untuk pembuatan tapak kendaraan, selang dan ikat pinggang, serta untuk pelapis kaleng logam.
-Kopolimer propilena etilena digunakan dalam pembuatan selang, bagian bodi dan sasis untuk mobil, pelapis tekstil, dll.
Alkena
-Mereka digunakan untuk mendapatkan pelarut seperti etilen glikol dan dioksan. Ethylene glycol digunakan sebagai antibeku di radiator mobil.
-Ethylene adalah hormon tanaman yang mengontrol pertumbuhan, perkecambahan biji dan perkembangan buah. Oleh karena itu, digunakan untuk menginduksi pematangan pisang ketika mereka mencapai tujuan mereka.
-Mereka digunakan sebagai bahan baku untuk pembuatan banyak senyawa seperti alkil halida, etilen oksida dan terutama etanol. Mereka juga digunakan dalam industri, perawatan pribadi, dan obat-obatan.
-Mereka digunakan untuk mendapatkan dan memproduksi lak, deterjen, aldehida dan bahan bakar. 1,3-butadiena digunakan sebagai bahan baku dalam pembuatan karet sintetis.
Referensi
- Tugas Kimia. Sifat Fisik Alkena. Diambil dari: chemistry-assignment.com
- Wikipedia. (2018). Alkena. Diambil dari: en.wikipedia.org
- LibreText Kimia. Sifat Fisik Alkena. Diambil dari: chem.libretexts.org
- Whitten, Davis, Peck & Stanley. Kimia. (edisi ke-8). CENGAGE Belajar.
- Francis A. Carey. Kimia organik. (Edisi keenam, H. 194). Bukit Mc Graw.
- Houghton Mifflin Harcourt. (2016). Alkena: Rumus Molekul dan Struktural. Diambil dari: cliffsnotes.com
- Chipera, Angie. (25 April 2017). Apa itu Olefin dalam Kimia? Sains. Diambil dari: sciencing.com