 Oksidasi Vs Reduksi
Oksidasi Vs Reduksi
Oksidasi adalah reaksi di mana atom, ion, atau molekul kehilangan elektron sedangkan reduksi berhubungan dengan atom, ion, atau molekul yang mendapatkan elektron. Oksidasi dan reduksi bergantung pada perubahan keadaan oksidasi atom, yaitu perbedaan muatan atom dalam suatu reaksi.
Reaksi oksidasi dan reduksi selalu terjadi secara bersamaan sehingga umumnya dikenal sebagai reaksi oksidasi-reduksi atau reaksi redoks . Misalnya, pembakaran dan korosi adalah reaksi oksidasi-reduksi.
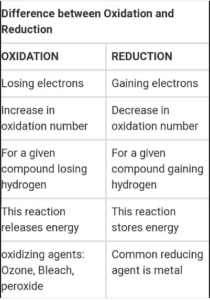
Perbedaan antara Oksidasi dan Reduksi dalam bentuk tabel
| Oksidasi | Pengurangan | |
| Definisi | Semi reaksi dimana atom, ion atau molekul kehilangan elektron. | Semi reaksi di mana atom, ion atau molekul memperoleh elektron. |
| konsep kunci | Oksidasi adalah hilangnya elektron. | Reduksi adalah perolehan elektron. |
| persamaan parsial | Zn→ Zn2 + + 2e – | Cu 2+ + 2e – → Cu |
| Keadaan oksidasi | meningkat | menurun |
| agen yang terlibat | Agen pengoksidasi adalah salah satu yang menjebak elektron.
Agen teroksidasi adalah salah satu yang kehilangan elektron. |
Agen pereduksi adalah salah satu yang menyediakan elektron.
Zat tereduksi adalah zat yang memperoleh elektron. |
| contoh | Oksidasi metanol menjadi formaldehida:
CH 3 OH → CH 2 O + H 2 Perpindahan atom magnesium Mg ke ion magnesium Mg 2+ |
Pembentukan perak dari ion perak.
Bagian oksigen molekuler O 2 ke oksida O -2 |
Apa itu oksidasi?
Oksidasi adalah hilangnya elektron oleh molekul, atom, atau ion. Suatu unsur teroksidasi ketika kehilangan elektron dalam suatu reaksi; ini dibuktikan dengan peningkatan keadaan oksidasi atom. Semakin tinggi tingkat oksidasi atom, semakin besar tingkat oksidasi.
Kata “oksidasi” pertama kali digunakan pada abad ke-18 berkat karya ahli kimia Perancis Antoine Lavoisier ketika ia mengidentifikasi oksigen di udara. Pada saat itu, semua reaksi dimana oksigen adalah reaktan digambarkan sebagai reaksi oksidasi. Hari ini kita tahu bahwa tidak semua reaksi oksidasi melibatkan partisipasi oksigen.
persamaan oksidasi parsial
Persamaan oksidasi parsial adalah bagian dari reaksi keseluruhan di mana unsur yang mengalami oksidasi disajikan dan jumlah elektron yang dilepaskan darinya di sisi kanan produk. Misalnya, dalam reaksi korosi aluminium:
4Al + 3O 2 → 2Al 2 O 3
Persamaan oksidasi parsial untuk aluminium adalah:
Al 0 → Al +3 + 3e –
Dalam hal ini, keadaan oksidasi aluminium dalam keadaan unsurnya adalah 0 (nol) dan teroksidasi menjadi ion aluminium dengan keadaan oksidasi +3; yaitu, keadaan oksidasi aluminium meningkat.
Oksidator dan oksidator
Agen pengoksidasi adalah agen yang menyebabkan bahan kimia lain teroksidasi. Misalnya, ketika magnesium bereaksi dengan oksigen membentuk magnesium oksida:
2Mg(s) + O2 (g)→ 2MgO(s) ,
oksigen menyebabkan magnesium kehilangan elektron, oleh karena itu oksigen adalah zat pengoksidasi dan magnesium adalah bahan kimia yang teroksidasi. Logam, seperti besi, tembaga, dan magnesium mudah teroksidasi.
Contoh reaksi oksidasi
- Dehidrogenasi metanol menjadi formaldehida:
CH3OH → H2C =O
- Atom magnesium kehilangan dua elektron dan menjadi ion magnesium:
Mg(s)→Mg 2+ (s) +2e –
- Transformasi alkohol menjadi cuka adalah reaksi oksidasi:
CH3CH2OH → CH3COOH _ _ _ _
Apa itu reduksi?
Reduksi adalah perolehan elektron oleh molekul, atom, atau ion. Suatu unsur berkurang ketika memperoleh elektron dalam suatu reaksi. Ini dibuktikan dengan penurunan keadaan oksidasi . Semakin rendah tingkat oksidasi suatu atom, semakin besar tingkat reduksinya.
Misalnya, pertukaran ion tembaga, dengan keadaan oksidasi 2+, beralih ke tembaga padat, dengan keadaan oksidasi 0:
Cu 2+ (aq) + 2e – → Cu(s)
Kata “reduksi” berasal dari bahasa Latin reduco, yang berarti “memulihkan”. Proses ekstraksi logam dianggap sebagai pemulihan logam dari senyawa mineralnya, seperti besi dari besi oksida atau tembaga dari tembaga(II) oksida.
persamaan reduksi parsial
Persamaan reduksi parsial adalah bagian dari reaksi keseluruhan di mana elemen yang mengalami reduksi dan jumlah elektron yang diterimanya di sisi kiri reaktan disajikan. Misalnya, dalam reaksi korosi aluminium:
4Al + 3O 2 → 2Al 2 O 3
persamaan reduksi oksigen parsial adalah:
ATAU 0 + 2e -2 → ATAU -2
Dalam hal ini, keadaan oksidasi oksigen dalam keadaan molekulnya adalah 0 (nol) dan direduksi menjadi ion oksida dengan keadaan oksidasi -2; yaitu, keadaan oksidasi oksigen berubah dari 0 menjadi -2, ia menurun.
Reduktor dan reduktor
Agen pereduksi menyebabkan bahan kimia lain tereduksi. Misalnya, ketika magnesium bereaksi dengan oksigen membentuk magnesium oksida:
2Mg(s) + O2 (g)→ 2MgO(s) ,
magnesium menyebabkan oksigen memperoleh elektron, sehingga magnesium berfungsi sebagai zat pereduksi sementara oksigen tereduksi.
Logam cenderung kehilangan elektron sehingga bertindak sebagai agen pereduksi.
Contoh Reaksi Reduksi
- Oksigen molekul mendapatkan empat elektron untuk menjadi ion oksida:
O 2 (g) +4e – →2O 2-
- Pembentukan perak dari ion perak:
Ag + (aq) +e – →Ag(s)
Anda mungkin juga tertarik pada:
-
- Oksidasi dan Reduksi
- Kaca Vs Kristal
- Cabang Kimia
- Anabolisme dan Katabolisme