Trietilamina adalah senyawa organik, lebih khusus amina alifatik, yang rumus kimia adalah N (CH 2 CH 3 ) 3 atau Net 3 . Seperti amina cair lainnya, ia memiliki bau yang mirip dengan bau amonia yang dicampur dengan ikan; uapnya membuatnya membosankan dan berbahaya untuk menangani zat ini tanpa tudung ekstraktor atau pakaian yang sesuai.
Selain rumusnya masing-masing, senyawa ini sering disingkat TEA; namun, ini dapat menyebabkan kebingungan dengan amina lain, seperti trietanolamin, N (EtOH) 3 , atau tetraetilamonium, amina kuaterner, NET 4 + .
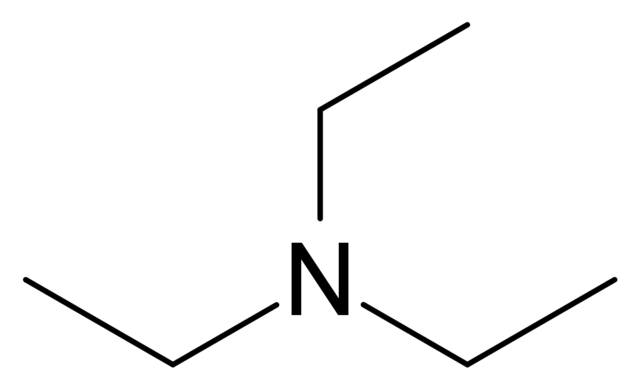
kerangka trietilamina. Sumber: Campuran [CC BY-SA 3.0 (http://creativecommons.org/licenses/by-sa/3.0/)]
Dari kerangkanya (gambar atas), dapat dikatakan bahwa trietilamina sangat mirip dengan amonia; sedangkan yang kedua memiliki tiga hidrogen, NH 3 , yang pertama memiliki tiga gugus etil, N (CH 2 CH 3 ) 3 . Sintesisnya dimulai dari perlakuan amonia cair dengan etanol, terjadi alkilasi.
NET 3 dapat membentuk garam higroskopis dengan HCl: trietilamina hidroklorida, NET 3 · HCl. Selain itu, ia berpartisipasi sebagai katalis homogen dalam sintesis ester dan amida, menjadikannya pelarut yang diperlukan di laboratorium organik.
Juga, bersama-sama dengan reagen lainnya, memungkinkan oksidasi alkohol primer dan sekunder menjadi aldehida dan keton, masing-masing. Seperti amonia, itu adalah basa, dan karena itu dapat membentuk garam organik melalui reaksi netralisasi.
Struktur trietilamina
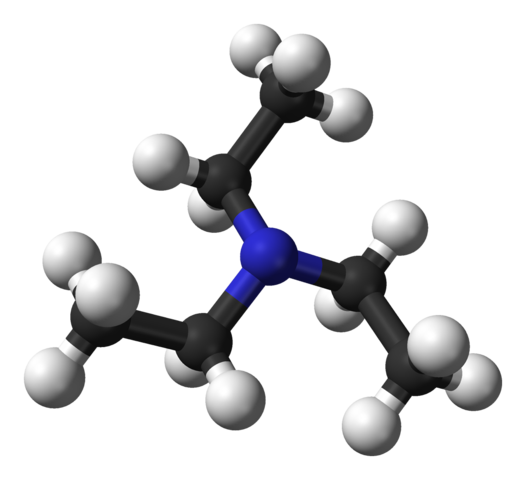
Struktur trietilamina. Sumber: Benjah-bmm27 [Domain publik].
Gambar atas menunjukkan struktur trietilamina dengan model bola dan batang. Di pusat molekul adalah atom nitrogen, diwakili oleh bola kebiruan; dan terkait dengannya, tiga kelompok etil, seperti cabang kecil dari bola hitam dan putih.
Meskipun mereka tidak terlihat dengan mata telanjang, pada atom nitrogen ada sepasang elektron yang tidak digunakan bersama. Kedua elektron ini dan ketiga gugus -CH 2 CH 3 mengalami tolakan elektronik; tetapi di sisi lain, mereka berkontribusi untuk menentukan momen dipol molekul.
Namun, momen dipol seperti itu lebih kecil dari, misalnya, dietilamina, NHEt 2 ; dan juga, ia tidak memiliki kemungkinan ikatan hidrogen.
Ini karena tidak ada ikatan NH di trietilamina, dan akibatnya, titik leleh dan titik didih yang lebih rendah diamati dibandingkan dengan amina lain yang berinteraksi sedemikian rupa.
Meskipun ada sedikit momen dipol, gaya hamburan antara gugus etil molekul NET 3 yang bertetangga tidak dapat dikesampingkan . Menambahkan efek ini, dibenarkan mengapa, meskipun trietilamina mudah menguap, ia mendidih pada sekitar 89ºC, berkat massa molekulnya yang relatif besar.
Sifat Trietilamina
Penampilan fisik
Cairan tidak berwarna dengan bau amonia dan ikan yang tidak enak.
Masa molar
101.193 gr/mol.
Titik didih
89 °C.
Titik lebur
-115 °C Perhatikan betapa lemahnya gaya antarmolekul yang mengikat molekul trietilamina dalam padatannya.
Kepadatan
0,7255 g/mL.
Kelarutan
Ini relatif larut dalam air, 5,5 g / 100g pada 20ºC. Di bawah 18,7 C, menurut Pubchem, bahkan dapat bercampur dengannya.
Selain “bergaul” dengan air, ia juga larut dalam aseton, benzena, etanol, eter, dan parafin.
Kepadatan uap
3,49 dalam rasio udara.
Tekanan uap
57,07 mmHg pada 25 ° C.
konstanta Henry
66 mol / Pa · Kg.
titik nyala
-15 °C.
Suhu penyalaan otomatis
312 °C.
Kapasitas panas
216,43 kJ / mol.
Panas pembakaran
10.248 kal/g.
Panas penguapan
34,84 kJ / mol.
Tegangan permukaan
20,22 N / m pada 25 ° C.
Indeks bias
1.400 pada 20 ° C.
Viskositas
0,347 mPa · s pada 25 ° C.
Konstanta dasar
Trietilamina memiliki pKb sama dengan 3,25.
Basa
Kebasaan untuk amina ini dapat dinyatakan dengan persamaan kimia berikut:
NETT 3 + HA <=> NHEt 3 + + A –
Dimana HA adalah spesies asam lemah. Pasangan NHEt 3 + A – membentuk garam amonium tersier.
Asam terkonjugasi NHEt 3 + lebih stabil daripada amonium, NH 4 + , karena ketiga gugus etil menyumbangkan sebagian dari kerapatan elektroniknya untuk mengurangi muatan positif pada atom nitrogen; oleh karena itu, trietilamina lebih basa daripada amonia (tetapi kurang basa daripada OH – ).
Kegunaan Trietilamina
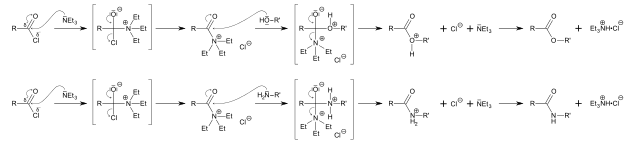
Reaksi yang dikatalisis oleh trietilamina. Sumber: Tachymètre [Domain publik].
Kebasaan, dalam hal ini, nukleofilisitas trietilamina digunakan untuk mengkatalisis sintesis ester dan amida dari substrat umum: asil klorida, RCOCl (gambar atas).
Di sini pasangan elektron bebas dari nitrogen menyerang gugus karbonil, membentuk zat antara; yang, berturut-turut, diserang oleh alkohol atau amina untuk membentuk ester atau amida, masing-masing.
Pada baris pertama gambar mekanisme yang diikuti oleh reaksi untuk menghasilkan ester divisualisasikan, sedangkan baris kedua sesuai dengan amida. Perhatikan bahwa dalam kedua reaksi trietilamina hidroklorida, bersih 3 · HCl, diproduksi , dari mana katalis pulih untuk memulai siklus lain.
Polimer
Nukleofilisitas trietilamina juga digunakan untuk menambah polimer tertentu, menyembuhkannya dan memberi mereka massa yang lebih besar. Misalnya, ini adalah bagian dari sintesis resin polikarbonat, busa poliuretan, dan resin epoksi.
Kromatografi
Sifat amfifilis dan volatilitasnya yang jauh memungkinkan garam turunannya digunakan sebagai reagen dalam kromatografi penukar ion. Penggunaan implisit lain dari trietilamina adalah bahwa berbagai garam amina tersier dapat diperoleh darinya, seperti trietilamina bikarbonat, NHEt 3 HCO 3 (atau TEAB).
Produk komersial
Ini telah digunakan sebagai aditif dalam rumussi rokok dan tembakau, pengawet makanan, pembersih lantai, perasa, pestisida, pewarna, dll.
Resiko
Asap trietilamina tidak hanya tidak menyenangkan tetapi juga berbahaya, karena dapat mengiritasi hidung, tenggorokan, dan paru-paru, yang menyebabkan edema paru atau bronkitis. Demikian juga, karena lebih padat dan lebih berat daripada udara, mereka tetap rata dengan tanah, pindah ke sumber panas yang mungkin untuk kemudian meledak.
Wadah cairan ini harus berada sejauh mungkin dari api karena dapat menimbulkan bahaya ledakan.
Selain itu, kontaknya dengan spesies atau reagen seperti: logam alkali, asam trikloroasetat, nitrat, asam nitrat (karena akan membentuk nitrosoamin, senyawa karsinogenik), asam kuat, peroksida dan permanganat harus dihindari.
Seharusnya tidak menyentuh aluminium, tembaga, seng atau paduannya, karena memiliki kemampuan untuk menimbulkan korosi.
Mengenai kontak fisik, dapat menyebabkan alergi dan ruam kulit jika paparannya akut. Selain paru-paru, dapat mempengaruhi hati dan ginjal . Dan mengenai kontak mata, hal itu menyebabkan iritasi, yang bahkan dapat merusak mata jika tidak dirawat atau dibersihkan tepat waktu.
Referensi
- Morrison, RT dan Boyd, R, N. (1987). Kimia organik. Edisi ke-5. Editorial Addison-Wesley Interamericana.
- Carey F. (2008). Kimia organik. (Edisi keenam). Bukit Mc Graw.
- Graham Solomons TW, Craig B. Fryhle. (2011). Kimia organik. amina. (edisi ke-10.). Wiley Plus.
- Wikipedia. (2019). Trietilamina. Dipulihkan dari: en.wikipedia.org
- Merck. (2019). Trietilamina. Dipulihkan dari: sigmaaldrich.com
- Pusat Nasional Informasi Bioteknologi. (2019). Trietilamina. Basis Data PubChem. ID = 8471. Dipulihkan dari: pubchem.ncbi.nlm.nih.gov
- Jaringan Data Toksikologi. (sf). Trietilamina. Dipulihkan dari: toxnet.nlm.nih.gov
- Departemen Kesehatan New Jersey. (2010). Trietilamina. Dipulihkan dari: nj.gov