Magnesium hidrida (MgH 2 rumus molekul), adalah senyawa kimia yang mengandung berat dalam 7.66% hidrogen, dan ditemukan di alam sebagai kristal putih solid. Hal ini digunakan terutama untuk mempersiapkan zat kimia lainnya, meskipun juga telah dipelajari sebagai media penyimpanan potensial untuk hidrogen.
Itu milik keluarga saline (atau ion) hidrida, yang didefinisikan oleh ion H bermuatan negatif. Hidrida ini dianggap yang terbentuk dari logam alkali dan logam alkali tanah, tetapi dalam kasus magnesium (dan berilium) mereka memiliki ikatan kovalen, selain ion yang menjadi ciri keluarga hidrida ini.
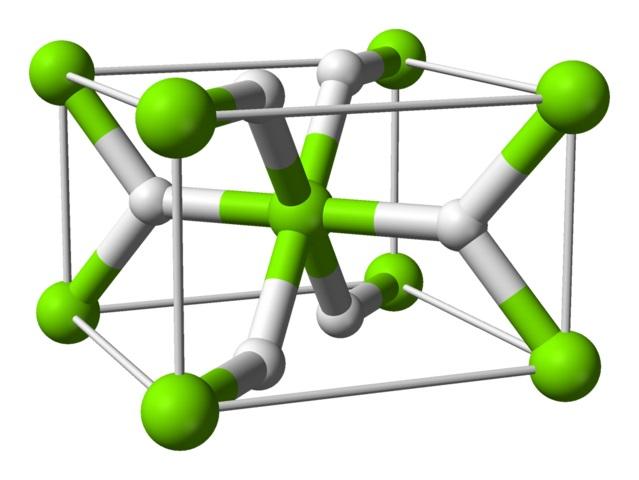
Model sel satuan magnesium hidrida, MgH2.
Persiapan dan rumus
Magnesium hidrida dibentuk melalui hidrogenasi langsung dari logam magnesium (Mg) di bawah kondisi tekanan dan suhu tinggi (200 atmosfer, 500 ° C) dengan katalis MgI 2 . Reaksi Anda sama dengan:
Mg + H 2 → MGH 2
Produksi MGH 2 pada suhu yang lebih rendah dengan penggunaan nanokristalin magnesium diproduksi di pabrik bola juga telah diteliti .
Ada juga metode persiapan lainnya, tapi mereka mewakili reaksi kimia yang lebih kompleks (hidrogenasi magnesium-antrasena; reaksi antara diethylmagnesium dengan hidrida lithium-aluminium, dan sebagai produk dari MGH 2 kompleks ).
Struktur kimia
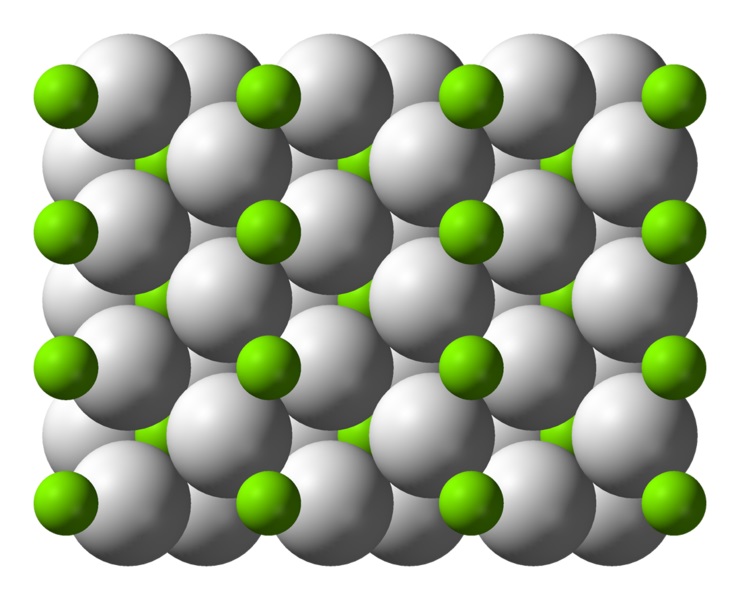
Struktur kristal magnesium hidrida
Atom ini memiliki struktur rutil pada suhu kamar, dengan struktur kristal tetragonal. Ini memiliki setidaknya empat bentuk berbeda di bawah kondisi tekanan tinggi, dan struktur non-stoikiometrik dengan kekurangan hidrogen juga telah diamati; yang terakhir hanya terjadi dalam jumlah partikel yang sangat kecil ketika terbentuk.
Seperti disebutkan di atas, ikatan yang ada dalam struktur rutil memiliki sebagian sifat kovalen daripada murni ion seperti hidrida garam lainnya.
Hal ini membuat atom magnesium memiliki bentuk bulat, terionisasi penuh, tetapi ion hidridanya memiliki struktur memanjang.
Sifat magnesium hidrida:
Sifat fisik
- Penampilan: Kristal putih.
- Massa Molar: 26,3209 g / mol
- Kepadatan: 1,45 g / cm 3
- Titik lebur: 285 ° C terurai
- Kelarutan: Dalam air terurai.
Senyawa kimia ini memiliki berat molekul 26.321 g/mol, massa jenis 1,45 g/cm³ dan memiliki titik leleh 327 C.
Sifat kimia
- Prekursor untuk pembuatan zat kimia lainnya.
- Penyimpanan hidrogen, sebagai kemungkinan sumber energi.
- Agen pereduksi dalam sintesis organik.
Penting untuk menunjukkan bahwa senyawa ini tidak dapat dibawa ke keadaan cair , dan ketika dibawa ke titik lelehnya atau dimasukkan ke dalam air, ia terurai. Hidrida ini tidak larut dalam eter.
Ini adalah zat yang sangat reaktif dan sangat mudah terbakar, dan juga piroforik, yaitu dapat menyala secara spontan di udara. Ketiga kondisi ini mewakili risiko keamanan yang akan disebutkan di bagian terakhir artikel ini.
Aplikasi/ kegunaan
Penyimpanan hidrogen
Magnesium hidrida mudah bereaksi dengan air membentuk gas hidrogen, melalui reaksi kimia berikut:
MgH 2 + 2H 2 O → 2H 2 + Mg (OH) 2
Selanjutnya zat ini terurai pada suhu 287 C dan tekanan 1 bar, sebagai berikut:
MgH 2 → Mg + H 2
Oleh karena itu, penggunaan magnesium hidrida telah diusulkan sebagai media penyimpanan hidrogen untuk penggunaan dan transportasinya.
Hidrogenasi dan dehidrogenasi sejumlah logam magnesium diusulkan sebagai cara pengangkutan sejumlah gas hidrogen, sehingga memastikan bahwa tidak bocor selama pengangkutannya dan mewakili cara yang lebih aman dan lebih praktis daripada dengan penggunaan bejana bertekanan tinggi..
Reaksi hidrogenasi dan dehidrogenasi
Meskipun suhu dekomposisi magnesium hidrida merupakan batasan untuk penggunaannya, metode telah diusulkan untuk meningkatkan kinetika reaksi hidrogenasi dan dehidrogenasi. Salah satunya adalah dengan pengurangan ukuran partikel magnesium dengan penggunaan ball mill.
Lumpur
Selain itu, sistem telah diusulkan yang menghasilkan magnesium hidrida dalam bentuk lumpur (lebih mudah diatur dan lebih aman daripada dalam bentuk bubuk atau partikel padat lainnya), yang akan direaksikan dengan air untuk mendapatkan hidrogen yang diinginkan.
Diperkirakan bahwa lumpur yang disebutkan di atas akan terdiri dari hidrida yang digiling halus, dilindungi dengan lapisan pelindung minyak dan disuspensikan dalam bahan pendispersi untuk memastikan konsistensinya tanpa kehilangan bahan, dan tidak menyerap kelembapan dari lingkungan.
Lumpur ini memiliki keuntungan dapat dipompa melalui pompa diesel, bensin atau air yang umum, membuat proposal ini ekonomis dan juga efisien.
Sel bahan bakar
Magnesium hidrida dapat diimplementasikan dalam produksi sel bahan bakar canggih, dan juga dalam pembuatan baterai dan penyimpanan energi.
Transportasi dan energi
Selama dekade terakhir, penggunaan hidrogen sebagai sumber energi telah dipertimbangkan. Pengenalan hidrogen sebagai bahan bakar membutuhkan penemuan sistem penyimpanan yang aman dan dapat dibalik dengan kapasitas volumetrik tinggi (jumlah hidrogen per satuan volume ) dan gravimetri (jumlah hidrogen per satuan massa).
Alkilasi
Alkilasi (menambahkan gugus alkil CH 3 R ) senyawa organik dalam medium basa, di mana gugus -OH terdapat pada konsentrasi rendah dan pada suhu di atas titik leleh hidrida.
Dalam hal ini hidrogen hadir dalam magnesium hidrida (MgH 2 ), mengikat gugus -OH, membentuk air. Magnesium bebas dapat menerima halogen yang sering menyertai molekul alkil yang dimaksudkan untuk bergabung dengan rantai hidrokarbon.
Resiko
Reaksi dengan air
Seperti yang telah disebutkan, magnesium hidrida adalah zat yang bereaksi sangat mudah dan hebat dengan air, menghadirkan kemampuan untuk meledak dalam konsentrasi yang lebih tinggi.
Ini terjadi karena reaksi eksotermisnya menghasilkan panas yang cukup untuk menyalakan gas hidrogen yang dilepaskan dalam reaksi dekomposisi, yang mengarah ke reaksi berantai yang agak berbahaya.
Ini adalah piroforik
Magnesium hidrida juga bersifat piroforik, yang berarti dapat menyala secara spontan dengan adanya udara lembab, membentuk magnesium oksida dan air.
Penghirupan dalam bentuk padat atau kontak dengan uapnya tidak dianjurkan : zat dalam keadaan alami dan produk penguraiannya dapat menyebabkan cedera serius atau bahkan kematian.
Hal ini dapat menghasilkan larutan korosif dalam kontak dengan air dan kontaminasi. Kontak dengan kulit dan mata tidak dianjurkan, dan juga menyebabkan iritasi pada selaput lendir.
Magnesium hidrida belum terbukti menyebabkan efek kesehatan kronis, seperti kanker, cacat reproduksi atau konsekuensi fisik atau mental lainnya, tetapi disarankan untuk menggunakan alat pelindung saat menanganinya (terutama respirator atau masker, karena sifatnya yang bubuk halus).
Saat bekerja dengan zat ini, jaga kelembaban udara pada tingkat rendah, matikan semua sumber api dan pindahkan ke dalam drum atau wadah wadah lainnya.
Bekerja dengan konsentrasi besar zat ini harus selalu dihindari jika dapat dihindari, karena kemungkinan ledakan berkurang secara signifikan.
Jika terjadi tumpahan magnesium hidrida, area kerja harus diisolasi dan debu dikumpulkan dengan alat vakum. Anda tidak boleh menggunakan metode sapuan kering; meningkatkan kemungkinan beberapa reaksi dengan hidrida.
Referensi
- Zumdahl, SS (1998). Ensiklopedia Britannica. Diambil dari britannica.com.
- PubChem. (2005). PubChem Buka Basis Data Kimia. Diambil dari pubchem.ncbi.nlm.nih.gov.
- Hidrogen Aman, L. (2006). Kongres Mobil Hijau. Diambil dari greencarcongress.com.
- Kimia, C. (nd). Bahan Kimia Cameo. Diambil dari cameochemicals.noaa.gov.
- Layanan, NJ (1987). Departemen Kesehatan dan Layanan Senior New Jersey. Diambil dari nj.gov.