Konstanta ionisasi, disosiasi konstan atau keasaman konstan, adalah sifat yang mencerminkan kecenderungan zat untuk ion rilis hidrogen; yaitu, itu berhubungan langsung dengan kekuatan asam. Semakin tinggi nilai konstanta disosiasi (Ka), semakin besar pelepasan ion hidrogen oleh asam.
Ketika datang ke air, misalnya, ionisasinya dikenal sebagai ‘autoprotolisis’ atau ‘autoionisasi’. Di sini, molekul air menghasilkan H + ke yang lain, menghasilkan ion H 3 O + dan OH – , seperti yang dapat dilihat pada gambar di bawah.
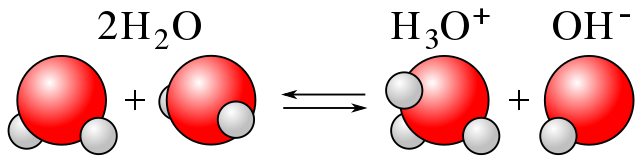
Sumber: Cdang [Domain publik], dari Wikimedia Commons
Disosiasi asam dari larutan berair dapat diuraikan sebagai berikut:
HA + H 2 O <=> H 3 O + + A -
Dimana HA mewakili asam yang terionisasi, H 3 O + ion hidronium, dan A – basa konjugasinya. Jika Ka tinggi, lebih banyak HA yang terdisosiasi dan oleh karena itu akan ada konsentrasi ion hidronium yang lebih tinggi. Peningkatan keasaman ini dapat ditentukan dengan mengamati perubahan pH larutan, yang nilainya di bawah 7.
Keseimbangan ionisasi
Panah ganda dalam persamaan kimia atas menunjukkan bahwa keseimbangan dibuat antara reaktan dan produk. Karena semua kesetimbangan memiliki konstanta, hal yang sama terjadi dengan ionisasi asam dan dinyatakan sebagai berikut:
K = [H 3 O + ] [A - ] / [HA] [H 2 O]
Secara termodinamika, konstanta Ka didefinisikan dalam bentuk aktivitas, bukan konsentrasi. Namun, dalam larutan encer aktivitas air adalah sekitar 1, dan aktivitas ion hidronium, basa konjugasi, dan asam tak terdisosiasi mendekati konsentrasi molarnya.
Untuk alasan ini, penggunaan konstanta disosiasi (ka) diperkenalkan yang tidak termasuk konsentrasi air. Hal ini memungkinkan disosiasi asam lemah untuk diskemakan dengan cara yang lebih sederhana, dan konstanta disosiasi (Ka) dinyatakan dalam bentuk yang sama.
HA <=> H + + A -
Ka = [H + ] [A - ] / [HA]
Ka
Konstanta disosiasi (Ka) adalah bentuk ekspresi dari konstanta kesetimbangan.
Konsentrasi asam yang tidak terdisosiasi, basa konjugasi, dan ion hidronium atau hidrogen tetap konstan setelah kondisi kesetimbangan tercapai. Sebaliknya, konsentrasi basa konjugasi dan konsentrasi ion hidronium persis sama.
Nilainya diberikan dalam pangkat 10 dengan eksponen negatif, sehingga bentuk ekspresi Ka yang lebih sederhana dan lebih mudah diatur diperkenalkan, yang mereka sebut pKa.
pKa = – log Ka
PKa biasa disebut konstanta disosiasi asam. Nilai pKa merupakan indikasi yang jelas dari kekuatan asam.
Asam yang memiliki nilai pKa kurang atau lebih negatif dari -1,74 (pKa ion hidronium) dianggap sebagai asam kuat. Sementara asam yang memiliki pKa lebih besar dari -1,74, mereka dianggap asam tidak kuat.
Persamaan Henderson-Hasselbalch
Persamaan yang sangat berguna dalam perhitungan analitik mengikuti dari ekspresi Ka.
Ka = [H + ] [A - ] / [HA]
Mengambil logaritma,
log Ka = log H + + log A - - log HA
Dan penyelesaian untuk log H + :
-log H = - log Ka + log A - - log HA
Kemudian menggunakan definisi pH dan pKa, dan istilah pengelompokan ulang:
pH = pKa + log (A - / HA)
Ini adalah persamaan Henderson-Hasselbalch yang terkenal.
Kegunaan
Persamaan Henderson-Hasselbach digunakan untuk memperkirakan pH buffer, serta bagaimana konsentrasi relatif basa konjugasi dan asam mempengaruhi pH.
Ketika konsentrasi basa konjugasi sama dengan konsentrasi asam, hubungan antara konsentrasi kedua istilah sama dengan 1; dan oleh karena itu logaritmanya sama dengan 0.
Akibatnya, pH = pKa, ini menjadi sangat penting, karena dalam situasi ini efisiensi buffering maksimum.
Zona pH dimana terdapat kapasitas buffer maksimum biasanya diambil, dimana pH = pka ± 1 unit pH.
Latihan konstan ionisasi
Latihan 1
Larutan encer asam lemah memiliki konsentrasi berikut dalam kesetimbangan: asam tak terdisosiasi = 0,065 M dan konsentrasi basa konjugasi = 9 · 10 -4 M. Hitung Ka dan pKa asam tersebut.
Konsentrasi ion hidrogen atau ion hidronium sama dengan konsentrasi basa konjugasi, karena keduanya berasal dari ionisasi asam yang sama.
Substitusi ke persamaan:
Ka = [H + ] [A – ] / HA
Mensubstitusikan dalam persamaan untuk nilai masing-masing:
Ka = (9 10 -4 M) (9 10 -4 M) / 65 10 -3 M
= 1,246 10 -5
Dan kemudian menghitung pKa.-nya
pKa = – log Ka
= – log 1,246 10 -5
= 4.904
Latihan 2
Asam lemah dengan konsentrasi 0,03 M memiliki konstanta disosiasi (Ka) = 1,5 · 10 -4 . Hitung: a) pH larutan berair; b) derajat ionisasi asam.
Pada kesetimbangan, konsentrasi asam sama dengan (0,03 M – x), di mana x adalah jumlah asam yang terdisosiasi. Oleh karena itu, konsentrasi ion hidrogen atau hidronium adalah x, seperti konsentrasi basa konjugasi.
Ka = [H + ] [A – ] / [HA] = 1,5 · 10 -6
[H + ] = [A – ] = x
Y [HA] = 0,03 M-x. Nilai Ka yang kecil menunjukkan bahwa asam kemungkinan terdisosiasi sangat sedikit, sehingga (0,03 M – x) kira-kira sama dengan 0,03 M.
Substitusi ke Ka:
1,5 10 -6 = x 2/3 10 -2
x 2 = 4,5 10 -8 M 2
x = 2,12 x 10 -4 M
Dan karena x = [H + ]
pH = – log [H + ]
= – log [2.12 x 10 -4 ]
pH = 3,67
Dan terakhir, mengenai derajat ionisasi: dapat dihitung dengan menggunakan persamaan berikut:
[H + ] atau [A – ] / HA] x 100%
(2.12 10 -4 / 3 10 -2 ) x 100%
0,71%
Latihan 3
Saya menghitung Ka dari persentase ionisasi asam, mengetahui bahwa itu terionisasi sebesar 4,8% dari konsentrasi awal 1,5 · 10 -3 M.
Untuk menghitung jumlah asam yang terionisasi, ditentukan 4,8%-nya.
Jumlah terionisasi = 1,5 · 10 -3 M (4,8 / 100)
= 7,2 x 10 -5 M
Jumlah asam terionisasi ini sama dengan konsentrasi basa konjugasi dan konsentrasi ion hidronium atau hidrogen pada kesetimbangan.
Konsentrasi asam kesetimbangan = konsentrasi asam awal – jumlah asam terionisasi.
[HA] = 1,5 · 10 -3 M – 7,2 · 10 -5 M
= 1.428 x 10 -3 M
Dan kemudian diselesaikan dengan persamaan yang sama
Ka = [H + ] [A – ] / [HA]
Ka = (7,2 10 -5 M x 7,2 10 -5 M) / 1,428 10 -3 M
= 3,63 x 10 -6
pKa = – log Ka
= – log 3,63 x 10 -6
= 5,44
Referensi
- LibreText Kimia. (sf). Konstanta disosiasi. Dipulihkan dari: chem.libretexts.org
- Wikipedia. (2018). Konstanta disosiasi. Dipulihkan dari: en.wikipedia.org
- Whitten, KW, Davis, RE, Peck, LP & Stanley, GG Kimia. (2008) Edisi Kedelapan. Cengage Belajar.
- Segel IH (1975). Perhitungan Biokimia. 2. Edisi. John Wiley & Sons. INC
- Kabara E. (2018). Cara Menghitung Konstanta Ionisasi Asam. Belajar. Dipulihkan dari: study.com.