Perpindahan kalor adalah proses pengaliran energi panas dari suatu benda ke benda lain atau dari suatu titik ke titik lain. Perpindahan kalor dapat terjadi melalui beberapa cara, seperti konduksi, konveksi, dan iradiasi.
Konduksi adalah cara perpindahan kalor yang terjadi melalui kontak langsung antara molekul atau partikel yang memiliki energi panas berbeda. Misalnya, konduksi dapat terjadi pada logam atau benda padat lainnya.
Konveksi adalah cara perpindahan kalor yang terjadi melalui gerakan cairan atau gas. Misalnya, konveksi dapat terjadi pada udara atau air yang dipanaskan.
Iradiasi adalah cara perpindahan kalor yang terjadi melalui gelombang cahaya atau radiasi. Misalnya, iradiasi dapat terjadi pada panas radiasi yang dipancarkan oleh matahari.
Perpindahan kalor dapat digunakan dalam beberapa aplikasi, seperti pemanasan ruangan, pendinginan ruangan, dan pengolahan makanan. Misalnya, perpindahan kalor dapat digunakan untuk mengubah energi panas menjadi tenaga listrik atau sebaliknya.
Untuk mengukur perpindahan kalor, dapat digunakan beberapa alat, seperti kalorimeter, termostat, dan termometer. Alat tersebut dapat mengukur sifat fisik dan kimiawi dari perpindahan kalor dan dapat digunakan dalam beberapa aplikasi, seperti pemanasan ruangan, pendinginan ruangan, dan pengolahan makanan.
Untuk mengoptimalkan pengukuran perpindahan kalor, dapat dilakukan beberapa langkah, seperti menggunakan alat yang tepat, menggunakan metode yang tepat, dan menggunakan standar yang tepat. Selain itu, pemerintah dan masyarakat juga dapat bekerjasama dalam melakukan pengelolaan yang baik dan benar terhadap penggunaan alat, metode, dan standar yang digunakan dalam pengukuran perpindahan kalor.
Perpindahan kalor dapat dipengaruhi oleh beberapa faktor, seperti tekanan, temperatur, dan waktu. Misalnya, perpindahan kalor dapat meningkat saat tekanan meningkat dan bertambah banyak energi panas yang masuk ke benda. Perpindahan kalor dapat juga meningkat saat temperatur naik dan bertambah banyak panas yang menghasilkan getaran pada benda.
Untuk mengatasi masalah yang timbul akibat perpindahan kalor, dapat dilakukan beberapa langkah, seperti menggunakan alat yang tepat, menggunakan metode yang tepat, dan menggunakan standar yang tepat. Selain itu, pemerintah dan masyarakat juga dapat bekerjasama dalam melakukan pengelolaan yang baik dan benar terhadap penggunaan alat, metode, dan standar yang digunakan dalam mengatasi masalah yang timbul akibat perpindahan kalor.
Pengertian
Kalor yang ditransfer adalah transfer energi antara dua badan pada temperatur yang berbeda. Yang bersuhu lebih tinggi melepaskan panas ke yang bersuhu lebih rendah. Apakah suatu benda melepaskan atau menyerap panas, suhu atau keadaan fisiknya dapat bervariasi tergantung pada massa dan ciri-ciri bahan dari mana benda itu dibuat.
Contoh yang baik adalah dalam secangkir kopi yang mengepul. Sendok logam yang digunakan untuk mengaduk gula menjadi panas. Jika dibiarkan dalam cangkir cukup lama, kopi dan sendok logam akan menyamakan suhunya: kopi akan mendingin dan panas akan diberikan ke sendok. Sebagian panas akan masuk ke lingkungan, karena sistem tidak diisolasi.

Kopi dan sendok berada dalam kesetimbangan termal setelah beberapa saat. Sumber: Pixabay.
Ketika suhu menjadi sama, kesetimbangan termal telah tercapai .
Jika Anda melakukan tes yang sama dengan sendok teh plastik, Anda pasti akan melihat bahwa itu tidak memanas secepat yang logam, tetapi pada akhirnya juga akan seimbang dengan kopi dan segala sesuatu di sekitarnya.
Ini karena logam menghantarkan panas lebih baik daripada plastik. Di sisi lain, tentunya kopi menghasilkan panas pada tingkat yang berbeda dari cokelat panas atau minuman lainnya. Jadi kalor yang diberikan atau diserap oleh setiap benda tergantung dari bahan atau zat apa benda itu dibuat.
Terdiri dari apa dan rumusnya
kalor selalu mengacu pada aliran atau perpindahan energi antara satu benda dengan benda lain, karena perbedaan suhu.
Itulah mengapa kita berbicara tentang panas yang dipindahkan atau panas yang diserap, karena dengan menambahkan atau mengekstraksi panas atau energi dalam beberapa cara, adalah mungkin untuk mengubah suhu suatu elemen.
Jumlah kalor yang dikeluarkan benda terpanas biasanya disebut Q. Nilai ini sebanding dengan massa benda tersebut. Benda dengan massa besar mampu melepaskan lebih banyak panas daripada benda lain yang massanya lebih rendah.
Perbedaan suhu T
Faktor penting lainnya dalam menghitung perpindahan panas adalah perbedaan suhu yang dialami oleh benda yang mentransfer panas. Ini dilambangkan sebagai T dan dihitung sebagai berikut:
T = T f – T o
Akhirnya, jumlah panas yang ditransfer juga tergantung pada sifat dan ciri-ciri objek, yang secara kuantitatif diringkas dalam konstanta yang disebut panas spesifik material , dilambangkan sebagai c .
Jadi akhirnya ekspresi untuk panas yang ditransfer adalah sebagai berikut:
Q yang dihasilkan = – mcΔT
Menyerah dilambangkan dengan tanda negatif.
Kalor jenis dan kapasitas kalor suatu zat
Kalor jenis adalah jumlah kalor yang diperlukan untuk menaikkan suhu 1 g zat sebesar 1 C. Ini adalah sifat intrinsik dari materi. Satuannya dalam Sistem Internasional adalah: Joule / kg. K (Joule antara kilogram x suhu dalam derajat Kelvin).
Kapasitas panas C adalah konsep yang terkait, tetapi sedikit berbeda, karena massa benda terlibat. Kapasitas panas didefinisikan sebagai berikut:
C = mc
Satuan SI-nya adalah Joule / K. Jadi kalor yang dilepaskan juga dapat dinyatakan secara ekuivalen sebagai:
Q = -C. T
Bagaimana cara menghitungnya?
Untuk menghitung kalor yang dilepaskan oleh suatu benda, perlu diketahui hal-hal berikut:
- – Kalor jenis zat yang melepaskan kalor.
- – Massa zat tersebut
- – Suhu akhir yang akan diperoleh
Nilai panas spesifik untuk banyak bahan telah ditentukan secara eksperimental dan tersedia dalam tabel.
Kalorimetri
Sekarang, jika nilai ini tidak diketahui, dimungkinkan untuk memperolehnya dengan bantuan termometer dan air dalam wadah berinsulasi termal: kalorimeter. Diagram perangkat ini ditunjukkan pada gambar yang menyertai latihan 1.
Sampel zat pada suhu tertentu direndam dalam sejumlah air yang diukur sebelumnya. Suhu akhir diukur dan panas spesifik bahan ditentukan dengan nilai yang diperoleh.
Dengan membandingkan hasil dengan nilai tabulasi, dapat diketahui zat apa itu. Prosedur ini disebut kalorimetri.
Keseimbangan panas dilakukan dengan menghemat energi:
Q yang dihasilkan + Q yang diserap = 0
Latihan yang diselesaikan
Latihan 1
Sepotong tembaga 0,35 kg dimasukkan pada suhu 150ºC dalam 500 mL air pada suhu 25ºC.
a) Suhu kesetimbangan akhir
b) Berapa banyak panas yang mengalir dalam proses ini?
Data
c tembaga = 385 J / kg. C
c air = 4180 J / kg. C
Kepadatan air: 1000 kg / m 3
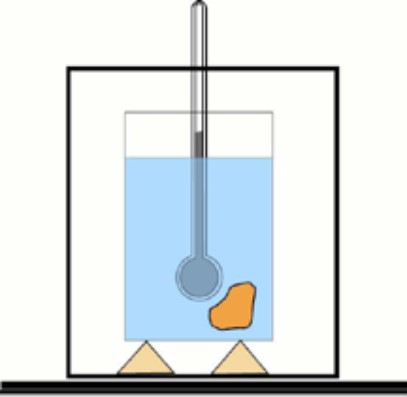
Skema kalorimeter dasar: wadah air yang diisolasi dan termometer untuk mengukur perubahan suhu. l Sumber: Dr. Tilahun Tesfaye [CC BY-SA 3.0 (https://creativecommons.org/licenses/by-sa/3.0)]
Penyelesaian
a) Tembaga melepaskan panas sementara air menyerapnya. Karena sistem dianggap tertutup, hanya air dan sampel yang campur tangan dalam keseimbangan panas:
Q yang dihasilkan = Q yang diserap
Di sisi lain, diperlukan untuk menghitung massa 500 mL air:
500 mL = 0,5 L = 0,0005 m 3
Dengan data ini massa air dihitung:
massa = massa jenis x volume = 1000 kg / m 3 . 0,0005 m 3 = 0,5 kg
Persamaan kalor tiap zat dinaikkan:
Q dihasilkan = -m tembaga . c . tembaga . T = -0,35 kg. 385 J / kg.°C. (T f –150 C) = -134,75 (T f – 150) J
Q yang diserap = m air . c air . T = 0,5 kg. 4186 J / kg. C.(T f –25 C) = 2093 (T f –25) J
Menyamakan hasil yang kita miliki:
2093 (T f – 25) = -134,75 (T f – 150)
Ini adalah persamaan linier dengan satu yang tidak diketahui, yang larutannya adalah:
T f = 32,56 ºC
b) Jumlah kalor yang mengalir adalah kalor yang dipindahkan atau kalor yang diserap:
Q yang dihasilkan = – 134,75 (32,56 – 150) J = 15823 J
Q yang diserap = 2093 (32,56 – 25) J = 15823 J
Latihan 2
Sepotong tembaga 100 g dipanaskan dalam tungku sampai suhu T o dan kemudian ditempatkan dalam kalorimeter tembaga 150 g berisi 200 g air pada 16ºC. Suhu akhir sekali dalam kesetimbangan adalah 38ºC. Ketika kalorimeter dan isinya ditimbang, ternyata 1,2 g air telah menguap.Berapa suhu awal T o ?
Data: kalor laten penguapan air adalah L v = 2257 kJ / kg
Penyelesaian
Latihan ini berbeda dari yang sebelumnya, karena kalorimeter juga harus menyerap panas. Panas yang dilepaskan oleh potongan tembaga diinvestasikan dalam semua hal berikut:
– Panaskan air dalam kalorimeter (200 g)
– Panaskan tembaga dari mana kalorimeter dibuat (150 g)
– Menguapkan 1,2 gram air (energi juga diperlukan untuk perubahan fasa).
Q yang dihasilkan = – 100 x 1 x 10 -3 kg. 385 J/kg. C. (38 – T o ) ° C = – 38.5 . (38 – T o ) J
Q diserap kalorimeter = Q diserap air + Q penguapan + Q diserap tembaga
0,2 kg.4186 J / kg ° C. (38 – 16 ° C) + 1,2 x 10 -3 kg. 2257000 J / kg +0,150 kg,385 J / kg.ºC. (38 – 16 C) =
18418.4 +2708.4 + 1270.5 J = 22397.3 J
Karena itu:
– 38.5 . (38 – T o ) = 22397.3
T o = 619,7 C
Kalor yang dibutuhkan untuk membawa 1,2 g air hingga 100ºC juga dapat dipertimbangkan, tetapi itu adalah jumlah yang cukup kecil jika dibandingkan.
Referensi
- Giancoli, D. 2006. Fisika: Prinsip dengan Kegunaan. 6 th . Ed.Prentice Hall. 400 – 410.
- Kirkpatrick, L. 2007. Fisika: Pandangan Dunia. 6 ta Editing disingkat. Cengage Belajar. 156-164.
- Rex, A. 2011. Dasar-dasar Fisika. Pearson. 309-332.
- Sears, Zemansky. 2016. Fisika Universitas dengan Fisika Modern. 14 th . Edisi Volume 1. 556 – 553.
- Serway, R., Vulle, C. 2011. Dasar-dasar Fisika. 9 na Cengage Belajar.
Post terkait
Kalor Sensibel: Pengertian, Contoh, dan Pertanyaan Umum
Konveksi Kalor: Mekanisme Penting dalam Perpindahan Panas
Kalorimeter: Pengertian, Jenis, dan Penerapannya dalam Analisis Kalor
Konduktivitas Termal: Sifat dan Peranannya dalam Pemindahan Panas