Hidrogenasi katalitik: adalah reaksi dimana molekul hidrogen ditambahkan ke senyawa pada kecepatan yang lebih tinggi. Tidak hanya harus dengan H 2 molekul pertama memecah ikatan kovalen, tetapi juga, yang begitu kecil, tabrakan efisien antara itu dan senyawa yang akan ditambahkan cenderung.
Senyawa reseptor hidrogen dapat berupa organik atau anorganik. Dalam senyawa organik di mana sebagian besar adalah contoh hidrogenasi katalitik; terutama yang memiliki aktivitas farmakologis, atau yang memiliki logam yang tergabung dalam strukturnya (senyawa organologam).
Sumber: Gabriel Bolívar
Apa yang terjadi ketika H 2 ditambahkan ke struktur karbon-dikemas? Ketidakjenuhannya berkurang, yaitu, karbon mencapai tingkat maksimum ikatan sederhana yang dapat dibentuknya.
Oleh karena itu, H 2 menambah ikatan rangkap dua (C = C) dan rangkap tiga (C≡C); meskipun itu juga dapat ditambahkan ke gugus karbonil (C = O).
Jadi, alkena dan alkuna yang ditambahkan bereaksi dengan hidrogenasi katalitik. Dengan menganalisis secara dangkal struktur apa pun, dapat diprediksi apakah akan menambahkan H 2 atau tidak hanya dengan mendeteksi ikatan rangkap dua dan rangkap tiga.
Ciri-ciri hidrogenasi katalitik
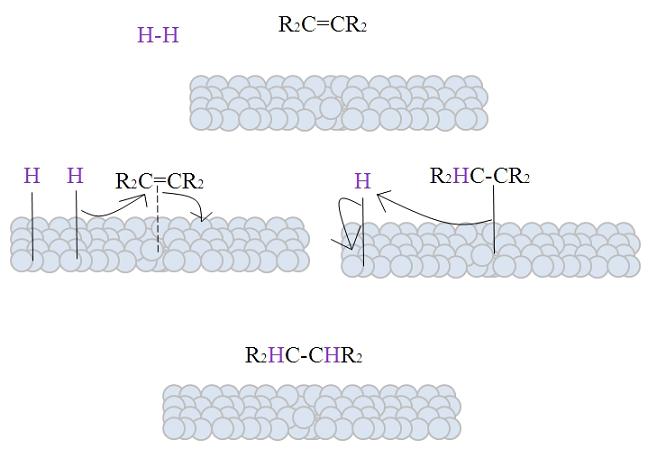
Gambar menunjukkan mekanisme reaksi ini. Namun, perlu untuk membahas beberapa aspek teoretis sebelum menjelaskannya.
Permukaan bola keabu-abuan mewakili atom logam yang, seperti akan terlihat, adalah katalis hidrogenasi par excellence.
Ikatan hidrogen putus
Pertama-tama, hidrogenasi adalah reaksi eksotermik, yaitu melepaskan panas sebagai akibat dari pembentukan senyawa dengan energi lebih rendah.
Hal ini dijelaskan oleh stabilitas ikatan CH yang terbentuk, yang membutuhkan lebih banyak energi untuk pemutusan berikutnya daripada yang dibutuhkan oleh ikatan HH molekul hidrogen.
Di sisi lain, hidrogenasi selalu melibatkan pemutusan ikatan HH terlebih dahulu. Pecahnya ini bisa bersifat homolitik, seperti yang terjadi dalam banyak kasus:
HH => H + H
Atau heterolitik, yang dapat terjadi, misalnya, ketika seng oksida, ZnO, dihidrogenasi:
HH => H + + H –
Perhatikan bahwa perbedaan antara dua pemutusan terletak pada bagaimana elektron dalam ikatan didistribusikan. Jika mereka didistribusikan secara merata (kovalen), setiap H akhirnya melestarikan satu elektron; sedangkan jika distribusinya ion, yang satu berakhir tanpa elektron, H + , dan yang lain memperolehnya sepenuhnya, H – .
Kedua ruptur dimungkinkan dalam hidrogenasi katalitik, meskipun homolitik memungkinkan untuk memberi jalan bagi pengembangan mekanisme logis untuk itu.
Eksperimental
Hidrogen adalah gas, dan oleh karena itu, ia harus digelembungkan dan harus dipastikan bahwa hanya hidrogen yang mendominasi permukaan cairan.
Sebaliknya, senyawa yang akan dihidrogenasi harus dilarutkan dalam suatu medium, baik itu air, alkohol, eter, ester atau amina cair; jika tidak, hidrogenasi akan berlangsung sangat lambat.
Untuk melarutkan senyawa yang akan dihidrogenasi, juga harus ada katalis dalam media reaksi. Ini akan bertanggung jawab untuk mempercepat kecepatan reaksi.
Dalam hidrogenasi katalitik, logam halus nikel, paladium, platinum atau rodium sering digunakan, yang tidak larut dalam hampir semua pelarut organik. Oleh karena itu akan ada dua fase: fase cair dengan senyawa dan hidrogen terlarut, dan fase padat, fase katalis.
Logam-logam ini menyediakan permukaannya sehingga hidrogen dan senyawanya bereaksi sedemikian rupa sehingga pemutusan ikatan dipercepat.
Demikian juga, mereka mengurangi ruang difusi spesies, meningkatkan jumlah tumbukan molekul efektif. Tidak hanya itu, bahkan reaksi berlangsung di dalam pori-pori logam.
Jenis Hidrogenasi katalitik
Homogen
Kita berbicara tentang hidrogenasi katalitik homogen ketika media reaksi terdiri dari satu fase. Di sini tidak ada tempat untuk penggunaan logam dalam keadaan murni, karena mereka tidak larut.
Sebagai gantinya, senyawa organologam dari logam ini digunakan, yang larut, dan telah terbukti memiliki hasil yang tinggi.
Salah satu senyawa organologam ini adalah katalis Wilkinson: tris (trifenilfosfin) rhodium klorida, [(C 6 H 5 ) 3 P] 3 RhCl. Senyawa ini membentuk kompleks dengan H 2 , mengaktifkannya untuk reaksi adisi berikutnya menjadi alkena atau alkuna.
Hidrogenasi homogen menghadirkan lebih banyak alternatif daripada heterogen. Mengapa? Karena kimia adalah senyawa organologam yang melimpah: cukup dengan mengubah logam (Pt, Pd, Rh, Ni) dan ligan (molekul organik atau anorganik yang terikat pada pusat logam), untuk mendapatkan katalis baru.
Heterogen
Hidrogenasi katalitik heterogen, seperti yang baru saja disebutkan, memiliki dua fase: satu cair dan lainnya padat.
Selain katalis logam, ada juga yang terdiri dari campuran padat; misalnya, katalis Lindlar, yang terdiri dari platinum, kalsium karbonat, timbal asetat, dan kuinolin.
Katalis Lindlar memiliki kekhasan yaitu kekurangan untuk hidrogenasi alkena; Namun, ini sangat berguna untuk hidrogenasi parsial, yaitu, ia bekerja dengan sangat baik pada alkuna:
RC≡CR + H 2 => RHC = CHR
Mekanisme
Gambar menunjukkan mekanisme hidrogenasi katalitik menggunakan bubuk logam sebagai katalis.
Bola keabu-abuan sesuai dengan permukaan logam, katakanlah, platinum. Molekul H 2 (warna ungu) mendekati permukaan logam seperti halnya alkena tersubstitusi tetra, R 2 C = CR 2 .
H 2 berinteraksi dengan elektron yang dijalankan melalui atom logam, dan pecah dan pembentukan ikatan sementara HM terjadi, di mana M adalah logam. Proses ini dikenal sebagai chemisorption ; yaitu, adsorpsi oleh kekuatan kimia.
Alkena berinteraksi dengan cara yang sama, tetapi ikatan tersebut dibentuk oleh ikatan rangkapnya (garis putus-putus). Ikatan HH telah terdisosiasi dan setiap atom hidrogen tetap terikat pada logam; itu melakukan hal yang sama dengan pusat logam di katalis organologam, membentuk kompleks HMH perantara.
Kemudian terjadi migrasi H menuju ikatan rangkap, dan ini membuka membentuk ikatan dengan logam. Sisa H kemudian mengikat karbon lain dari ikatan rangkap asli, dan alkana yang dihasilkan, R 2 HC-CHR 2 , akhirnya dilepaskan .
Mekanisme ini akan diulang sebanyak yang diperlukan, sampai semua H 2 telah sepenuhnya bereaksi.
Referensi
- Graham Solomons TW, Craig B. Fryhle. (2011). Kimia organik. amina. ( edisi ke- 10 .). Wiley Plus.
- Carey F. (2008). Kimia organik. (Edisi keenam). Bukit Mc Graw.
- Menggigil & Atkins. (2008). kimia anorganik. (Edisi keempat). Bukit Mc Graw.
- Lew J. (nd). Hidrogenasi Katalitik Alkena. LibreText Kimia. Dipulihkan dari: chem.libretexts.org
- Jones D. (2018). Apa itu Hidrogenasi Katalitik? – Mekanisme & Reaksi. Belajar. Diperoleh dari: study.com