Bagaimana mungkin begitu banyak pesawat yang mampu terbang tanpa harus bertemu dengan satu sama lain? Jalur penerbangan dari pesawat komersial diatur dengan hati-hati oleh Federal Aviation Administration. Setiap pesawat harus menjaga jarak lima mil dari pesawat lain yang terbang pada ketinggian yang sama dan 2.000 meter di atas dan di bawah pesawat lain (1.000 kaki jika ketinggian kurang dari 29.000 kaki).
Jadi, setiap pesawat hanya memiliki posisi tertentu yang diperbolehkan untuk dipertahankan ketika sedang terbang. Seperti yang akan kita eksplorasi dalam mekanika kuantum, kita melihat bahwa elektron memiliki batasan yang mirip di lokasi mereka.
Apa itu Orbital
Orbital atom adalah fungsi matematika yang menggambarkan perilaku seperti gelombang dari sebuah elektron dalam atom. Wilayah di mana elektron dapat ditemukan di sekitar atom tunggal dalam keadaan energi tertentu dapat dihitung dari fungsi ini. Sebuah orbital sering digambarkan sebagai daerah tiga dimensi di mana ada kemungkinan 95 persen untuk menemukan elektron (lihat gambar).
Dalam teori atom dan mekanika kuantum, orbital atom adalah fungsi matematika yang menggambarkan perilaku seperti gelombang dari satu elektron atau sepasang elektron dalam atom. Fungsi ini dapat digunakan untuk menghitung probabilitas menemukan elektron dari suatu atom di wilayah tertentu di sekitar inti atom. Istilah orbital atom juga dapat merujuk ke wilayah fisik atau ruang tempat elektron dapat dihitung, seperti yang diprediksi oleh bentuk matematika orbital tertentu.
Setiap orbital dalam atom ditandai oleh seperangkat nilai unik dari tiga bilangan kuantum n, ℓ, dan m, yang masing-masing sesuai dengan energi elektron, momentum sudut, dan komponen vektor momentum sudut (bilangan kuantum magnetik). Setiap orbital tersebut dapat ditempati oleh maksimal dua elektron, masing-masing dengan bilangan kuantum putarannya sendiri s. Nama-nama sederhana s orbital, p orbital, d orbital, dan f orbital merujuk ke orbital dengan jumlah kuantum momentum sudut ℓ = 0, 1, 2, dan 3. Nama-nama ini, bersama dengan nilai n, digunakan untuk menggambarkan konfigurasi elektron atom. Mereka berasal dari deskripsi oleh spektroskopi awal dari seri tertentu dari garis spektroskopi logam alkali sebagai tajam, utama, difus, dan fundamental. Orbitals untuk ℓ> 3 berlanjut secara alfabet, menghilangkan j (g, h, i, k,…) karena beberapa bahasa tidak membedakan antara huruf “i” dan “j”.
Orbital atom adalah blok bangunan dasar dari model orbital atom (alternatifnya dikenal sebagai awan elektron atau model mekanika gelombang), kerangka kerja modern untuk memvisualisasikan perilaku submikroskopik elektron dalam materi. Dalam model ini, awan elektron dari atom multi-elektron dapat dilihat dibangun (dalam perkiraan) dalam konfigurasi elektron yang merupakan produk orbital atom mirip hidrogen. Periodisitas berulang dari blok 2, 6, 10, dan 14 elemen dalam bagian tabel periodik muncul secara alami dari jumlah total elektron yang menempati set lengkap orbital atom s, p, d, dan f, masing-masing, walaupun untuk nilai-nilai bilangan kuantum n yang lebih tinggi, khususnya ketika atom yang dimaksud memiliki muatan positif, energi sub-kulit tertentu menjadi sangat mirip sehingga urutannya dikatakan dihuni oleh elektron (misalnya Cr = [Ar ] 4s13d5 dan Cr2 + = [Ar] 3d4) hanya dapat dirasionalisasi dengan sewenang-wenang.
Konfigurasi Elektron
Kita dapat menerapkan pengetahuan kita tentang bilangan kuantum untuk menggambarkan susunan elektron untuk atom tertentu. Kita melakukan hal ini dengan sesuatu yang disebut konfigurasi elektron. Mereka secara efektif memberi gambaran elektron untuk atom tertentu. Kita melihat empat bilangan kuantum untuk elektron tertentu dan kemudian menetapkan elektron ke orbital tertentu.
Bentuk Orbital s
Untuk setiap nilai n, nilai l = 0 tempat yang diisi elektron dalam orbital s. Orbital ini berbentuk bulat:

Diagram permukaan batas untuk orbital s tampak seperti bola yang memiliki inti sebagai pusatnya yang dalam dua dimensi dapat dilihat sebagai lingkaran.
Oleh karena itu, kita dapat mengatakan bahwa orbital s simetris sferis memiliki probabilitas untuk menemukan elektron pada jarak tertentu yang sama di semua arah.
Ukuran orbital s juga ditemukan meningkat dengan peningkatan nilai bilangan kuantum utama (n), dengan demikian, 4s> 3s> 2s> 1s.
Bentuk Orbital p
Dari Tabel di bawah ini kita melihat bahwa kita dapat memiliki tiga orbital yang mungkin bila l = 1. Ini disebut sebagai orbital p dan memiliki bentuk seperti lonceng. Setiap orbital p memiliki orientasi yang berbeda dalam ruang tiga dimensi.

Setiap orbital terdiri dari dua bagian yang lebih dikenal sebagai lobus yang terletak di kedua sisi bidang melewati nukleus.
Tiga orbital p berbeda dalam cara orientasi lobus sedangkan mereka identik dalam hal ukuran dan energi.
Karena lobus terletak di sepanjang salah satu sumbu x, y atau z, ketiga orbital ini diberi sebutan 2px, 2py, dan 2pz.
Jadi, kita dapat mengatakan bahwa ada tiga orbital p yang sumbunya saling tegak lurus.
Mirip dengan orbital s, ukuran, dan energi orbital p meningkat dengan peningkatan bilangan kuantum utama (4p> 3p> 2p).
Bentuk Orbital d
Ketika l = 2, nilai ml bisa -2, -1, 0, +1, +2 dengan total lima orbital d. Perhatikan bahwa semua lima orbital memiliki orientasi tiga dimensi yang spesifik.
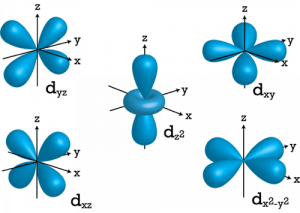
Bilangan kuantum orbital magnetik untuk orbital d diberikan sebagai (-2, -1,0, 1,2). Oleh karena itu, kita dapat mengatakan bahwa ada lima orbital d.
Orbital-orbital ini ditetapkan sebagai dxy, dyz, dxz, dx2–y 2 dan dz2.
Dari kelima orbital d ini, bentuk dari empat orbital d-pertama adalah sama satu sama lain, yang berbeda dari orbital dz2 sedangkan energi dari kelima orbital d adalah sama.
Orbital f
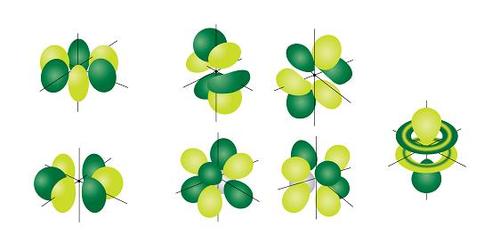
Yang paling kompleks dari orbital adalah orbital f. Ketika l = 3, nilai ml dapat -3, -2, -1, 0, +1, +2, +3 dengan total tujuh bentuk orbital yang berbeda. Sekali lagi, perhatikan orientasi khusus dari orbital f yang berbeda.
| Pengaturan Elektron Dalam Tingkat Energi | |||||
| Bilangan kuantum utama | Sub-tingkat yang diijinkan | Jumlah orbital tiap tingkat | Jumlah orbital tiap subtingkat energi utama | Jumlah elektron tiap sub tingkat | Jumlah elektron tiap tingkat energi utama |
| 1 | s | 1 | 1 | 2 | 2 |
| 2 | s
p |
1
3 |
4 | 2
6 |
8 |
| 3 | s
p d |
1
3 5 |
9 | 2
6 10 |
18 |
| 4 | s
p d f |
1
3 5 7 |
16 | 2
6 10 14 |
32 |
Contoh
Orbital s, p, d, f adalah orbital yang paling umum karena fakta bahwa mereka adalah tingkat energi yang lebih rendah yang dapat ditinggali oleh elektron. Setiap jenis orbital memiliki bentuk geometri spesifik masing-masing.
Unsur-unsur memiliki jumlah elektron tertentu yang berada di setiap tingkat tergantung pada berapa banyak elektron yang ada. Seperti atom hidrogen yang memiliki konfigurasi elektron 1s1 dan atom helium memiliki konfigurasi elektron 1s2.
Berikut adalah beberapa contoh orbital atom (konfigurasi elektron) yang lebih spesifik:
- Na: 1s22s22p63s1
- Kr: 1s22s22p63s23p64s23d104p6
- C: 1s22s22p2
Ringkasan
- Orbital atom adalah pernyataan matematika yang menggambarkan sifat-sifat karakteristik seperti gelombang dari sebuah elektron dalam atom atau molekul.
- Terdapat empat kelas yang berbeda dari orbital elektron.
- Orbital ini ditentukan oleh nilai dari sudut bilangan kuantum momentum l.