Litium fluorida adalah padat anorganik dengan rumus kimia LiF. Hal ini terdiri dari Li + dan F – ion, yang dihubungkan melalui ikatan ion . Ini ditemukan dalam jumlah kecil di berbagai mineral, terutama silikat seperti lepidolit, di air laut dan di banyak sumur mineral.
Ini telah banyak digunakan dalam perangkat optik karena transparansi dalam berbagai panjang gelombang, dari spektrum inframerah (IR) hingga ultraviolet UV, melewati yang terlihat.

Lepidolite, mineral yang mengandung sejumlah kecil lithium fluoride LiF. Rob Lavinsky, iRocks.com – CC-BY-SA-3.0 [CC BY-SA 3.0 (https://creativecommons.org/licenses/by-sa/3.0)]. Sumber: Wikimedia Commons.
Litium fluorida juga telah digunakan dalam perangkat untuk mendeteksi radiasi berbahaya dalam pekerjaan di mana orang-orang terpapar untuk waktu yang singkat. Selain itu, digunakan sebagai bahan untuk melelehkan aluminium atau untuk membuat kacamata untuk lensa atau kacamata dan dalam pembuatan keramik.
Ini berfungsi sebagai bahan pelapis untuk komponen baterai lithium ion dan untuk mencegah kehilangan muatan awal.
Struktur
Litium fluorida merupakan senyawa ion, yang, dibentuk oleh persatuan Li + kation dan F – anion . Gaya yang menyatukan mereka adalah elektrostatik dan disebut ikatan ion.
Ketika litium bergabung, ia melepaskan elektron menjadi fluor, meninggalkan keduanya dalam bentuk yang lebih stabil daripada yang awal, seperti yang dijelaskan di bawah ini.
Unsur litium memiliki konfigurasi elektron sebagai berikut: [He] 1s 2 2s 1 dan ketika melepaskan elektron, struktur elektroniknya terlihat seperti ini: [He] 1s 2 yang jauh lebih stabil.
Unsur fluor yang konfigurasi elektronnya adalah: [Ne] 1s 2 2s 2 2p 5 , ketika menerima elektron ia tetap dalam bentuk [Ne] 1s 2 2s 2 2p 6 , lebih stabil.
Tata nama
- – Litium fluorida
- – Fluorolitium
- – Litium monofluorida
Sifat
Keadaan fisik
Padatan putih, yang mengkristal dalam struktur kubik, seperti natrium klorida NaCl.
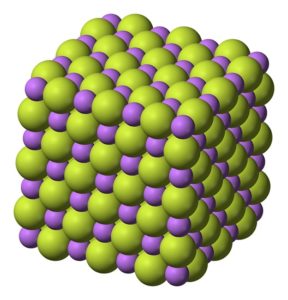
Struktur kubik kristal lithium fluoride LiF. Benjah-bmm27 [Domain publik]. Sumber: Wikimedia Commons.
Berat molekul
26 g / mol
Titik lebur
848.2 C
Titik didih
1673 C, meskipun menguap pada 1100-1200 C
Kepadatan
2.640 g / cm 3
Indeks bias
1.3915
Kelarutan
Sedikit larut dalam air: 0,27 g / 100 g air pada 18 C; 0,134 g / 100 g pada 25 ° C. Larut dalam media asam. Tidak larut dalam alkohol.
Sifat lainnya
Uapnya menghadirkan spesies dimer (LiF) 2 dan trimerik (LiF) 3 . Dengan asam fluorida HF membentuk litium bifluorida LiHF 2 ; Dengan lithium hidroksida membentuk garam ganda LiF.LiOH.
Koleksi dan kelimpahan
Litium fluorida LiF dapat diperoleh dengan reaksi antara asam fluorida HF dan litium hidroksida LiOH atau litium karbonat Li 2 CO 3 .
Namun, hadir dalam jumlah kecil dalam mineral tertentu seperti lepidolite dan air laut.

Lithium fluoride ditemukan dalam jumlah kecil di air laut. Adeeb Atwan [CC BY 3.0 (https://creativecommons.org/licenses/by/3.0)]. Sumber: Wikimedia Commons.
Kegunaan
Dalam kegunaan optik
LiF digunakan dalam bentuk kristal kompak dalam spektrofotometer inframerah (IR) karena dispersi yang sangat baik yang mereka hadirkan dalam kisaran panjang gelombang antara 4000 dan 1600 cm -1 .
Kristal besar LiF diperoleh dari larutan jenuh garam ini. Ini dapat menggantikan kristal fluorit alami di berbagai jenis perangkat optik.
Kristal besar dan murni digunakan dalam sistem optik untuk sinar ultraviolet (UV), cahaya tampak dan IR, serta pada monokromator sinar-X (0,03-0,38 nm).

Kristal LiF fluorida lithium besar, di dalam gelas kimia. V1adis1av [Domain publik]. Sumber: Wikimedia Commons.
Ini juga digunakan sebagai bahan pelapis optik untuk wilayah UV karena pita optiknya yang lebar, lebih besar dari fluorida logam lainnya.
Transparansinya dalam UV jauh (90-200 nm) membuatnya ideal sebagai lapisan pelindung pada cermin aluminium (Al). Cermin LiF / Al digunakan dalam sistem teleskop optik untuk kegunaan di luar angkasa.
Pelapisan ini dicapai dengan deposisi uap fisik dan deposisi lapisan pada tingkat atom.
Dalam pengion atau detektor radiasi berbahaya
Litium fluorida telah banyak digunakan dalam detektor termoluminesen untuk radiasi partikel foton, neutron dan (beta).
Detektor thermoluminescent menghemat energi radiasi ketika mereka terkena itu. Kemudian, ketika dipanaskan, mereka melepaskan energi yang tersimpan dalam bentuk cahaya.
Untuk kegunaan ini LiF umumnya didoping dengan pengotor magnesium (Mg) dan titanium (Ti). Pengotor ini menghasilkan tingkat energi tertentu yang bertindak sebagai lubang di mana elektron yang dilepaskan oleh radiasi terperangkap. Ketika material kemudian dipanaskan, elektron-elektron ini kembali ke keadaan energi aslinya, memancarkan cahaya.
Intensitas cahaya yang dipancarkan tergantung langsung pada energi yang diserap oleh material.
Detektor thermoluminescent LiF telah berhasil diuji untuk mengukur medan radiasi yang kompleks, seperti yang ada di Large Hadron Collider, atau LHC (untuk akronimnya English Large Hadron Collider ), yang terletak di Organisasi Eropa untuk Riset Nuklir, yang dikenal sebagai CERN ( untuk akronimnya dari bahasa Prancis Conseil Européen pour la Recherche Nucléaire ).
Radiasi dalam eksperimen yang dilakukan di pusat penelitian ini menghadirkan hadron, neutron dan elektron/positron, di antara jenis partikel subatom lainnya, yang semuanya dapat dideteksi dengan LiF.
Sebagai bahan untuk praliterasi katoda baterai lithium
LiF telah berhasil diuji dalam bentuk nanokomposit dengan kobalt (Co) dan besi (Fe) sebagai bahan untuk pralitiasi ( prelithiation ) bahan katoda baterai lithium ion.
Selama siklus pengisian pertama atau tahap pembentukan baterai lithium ion, elektrolit organik terurai untuk membentuk fase padat pada permukaan anoda.
Proses ini mengkonsumsi litium dari katoda dan mengurangi energi sebesar 5 hingga 20% dari total kapasitas baterai ion litium.
Untuk alasan ini, prelitiasi elektrokimia katoda telah diselidiki, yang menghasilkan ekstraksi elektrokimia lithium dari nanokomposit, yang bertindak sebagai donor lithium, sehingga menghindari konsumsi lithium dari katoda.
Nanokomposit LiF / Co dan LiF / Fe memiliki kapasitas tinggi untuk mendonorkan litium ke katoda, mudah disintesis, stabil dalam kondisi lingkungan, dan pemrosesan baterai.

Baterai ion lithium. Penulis: Tuan. Lithium_Battery * hari fotografi, Agustus 2005 * fotografer Aney. Sumber: Wikimedia Commons.
Dalam berbagai kegunaan
Lithium fluoride digunakan sebagai fluks pengelasan, terutama aluminium, dan pelapis untuk batang las. Ini juga digunakan dalam sel reduksi aluminium.
Ini banyak digunakan dalam pembuatan kacamata (seperti lensa) di mana koefisien ekspansi menurun. Ini juga digunakan dalam pembuatan keramik. Selain itu, digunakan dalam pembuatan enamel dan pernis kaca.
LiF adalah komponen bahan bakar roket dan bahan bakar untuk jenis reaktor tertentu.
LiF juga digunakan dalam dioda pemancar cahaya atau komponen fotovoltaik, untuk injeksi elektron di lapisan internal.
Referensi
- Kapas, F. Albert dan Wilkinson, Geoffrey. (1980). Kimia Anorganik Lanjut. Edisi keempat. John Wiley & Sons.
- Perpustakaan Kedokteran Nasional AS. (2019). Litium Fluorida. Dipulihkan dari: pubchem.ncbi.nlm.nih.gov.
- Obryk, B. dkk. (2008). Respon berbagai jenis detektor lithium fluorida TL terhadap medan radiasi campuran berenergi tinggi. Pengukuran Radiasi 43 (2008) 1144-1148. Dipulihkan dari sciencedirect.com.
- Sun, Y. dkk. (2016). Sintesis Kimia In Situ Lithium Fluoride / Metal Nanocomposite untuk Prelitiasi Katoda Berkapasitas Tinggi. Surat Nano 2016, 16, 2, 1497-1501. Dipulihkan dari pubs.acs.org.
- Hennessy, J. dan Nikzad, S. (2018). Deposisi Lapisan Atom dari Lapisan Optik Lithium Fluoride untuk Ultraviolet. Anorganik 2018, 6, 46. Diperoleh dari mdpi.com.