Apa itu Strontium Klorida?
Strontium klorida merupakan senyawa anorganik yang terdiri dari strontium, logam alkali tanah dan klorin halogen. Karena kedua unsur memiliki keelektronegatifan yang sangat berbeda, senyawa tersebut merupakan padatan ion yang rumus kimianya adalah SrCl 2 .
Karena merupakan padatan ion, ia terdiri dari ion. Dalam kasus SrCl 2 , mereka adalah satu kation Sr 2+ untuk setiap dua anion Cl – . Sifat dan kegunaannya mirip dengan kalsium dan barium klorida, dengan perbedaan bahwa senyawa strontium relatif jarang diperoleh dan karenanya lebih mahal.
Seperti kalsium klorida (CaCl 2 ), ia bersifat higroskopis dan kristalnya menyerap air untuk membentuk garam heksahidrat, di mana enam molekul air terdapat dalam kisi kristal (SrCl 2 · 6H 2 O). Bahkan, ketersediaan hidrat secara komersial lebih besar daripada SrCl 2 anhidrat (tanpa air).
Salah satu kegunaan utamanya adalah sebagai prekursor untuk senyawa strontium lainnya; yaitu, itu merupakan sumber strontium dalam sintesis kimia tertentu.
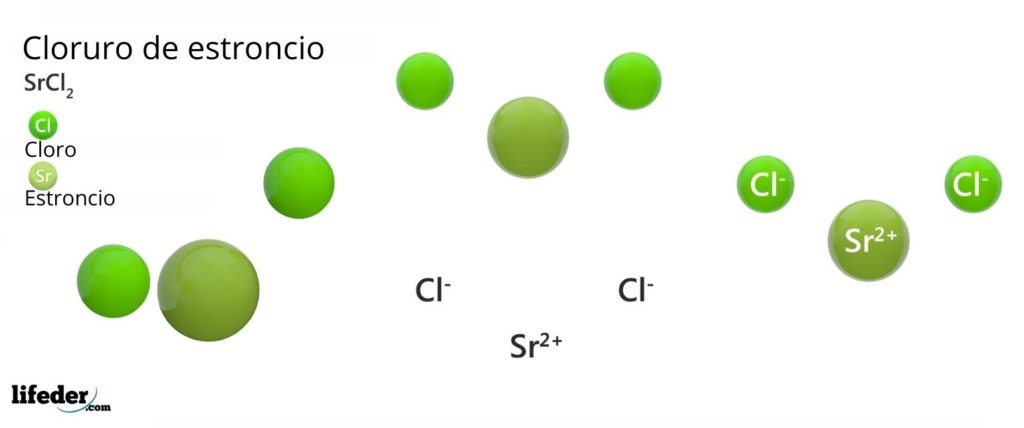
Struktur Kimia Strontium Klorida

Struktur kristal strontium klorida
Gambar atas mewakili struktur kristal tipe rutil yang terdeformasi dari SrCl 2 anhidrat. Dalam hal ini, bola hijau kecil sesuai dengan Sr 2+ ion , sedangkan bola hijau besar mewakili Cl – ion .
Dalam struktur ini setiap ion Sr 2+ “terperangkap” oleh delapan ion Cl – , akibatnya memiliki bilangan koordinasi sama dengan 8 dan, mungkin, geometri kubik di sekitarnya. Artinya, empat bola hijau membentuk atap kubus, sedangkan empat lainnya membentuk lantai, dengan Sr 2+ terletak di tengahnya.
Apa yang akan menjadi struktur dalam fase gas? Struktur Lewis untuk garam ini adalah Cl-Sr-Cl, tampaknya linier dan dengan asumsi kovalensi seratus persen dari ikatannya. Namun, dalam fase gas —SrCl 2 (g) – “garis” ini menunjukkan sudut kira-kira 130º, dalam kenyataannya semacam V.
Anomali ini tidak berhasil dijelaskan, mengingat fakta bahwa strontium tidak memiliki elektron yang tidak digunakan bersama yang menempati volume elektronik. Mungkin itu bisa disebabkan oleh partisipasi orbital d dalam ikatan, atau gangguan nukleus-elektron.
Kegunaan / Aplikasi Strontium Klorida
SrCl 2 · 6H 2 O telah digunakan sebagai aditif dalam polimer organik; misalnya, dalam alkohol polivinil, untuk memodifikasi sifat mekanik dan listriknya.
Ini digunakan sebagai ferit strontium dalam pembuatan magnet keramik dan kaca yang digunakan untuk membuat kaca depan televisi berwarna.
Bereaksi dengan natrium kromat (Na 2 CrO4) untuk menghasilkan strontium kromat (SrCrO 4 ), yang digunakan sebagai cat tahan korosi untuk aluminium.
Ketika dipanaskan dengan api, senyawa strontium bersinar dengan nyala kemerahan, itulah sebabnya mereka digunakan untuk membuat kembang api dan kembang api.
Kegunaan obat
Radioisotop strontium klorida 89 (isotop yang paling melimpah adalah 85 Sr) digunakan dalam bidang medis untuk mengurangi metastasis tulang, secara selektif disuntikkan secara intravena ke dalam jaringan tulang.
Penggunaan larutan encer (3-5%) selama lebih dari dua minggu dalam pengobatan rinitis alergi (radang kronis pada mukosa hidung), menunjukkan perbaikan dalam pengurangan bersin dan menggosok hidung.
Itu pernah digunakan dalam rumussi pasta gigi untuk mengurangi sensitivitas gigi dengan membentuk penghalang di atas mikrotubulus dentin.
Studi senyawa ini menunjukkan kemanjuran terapeutik dibandingkan dengan prednisolon (suatu metabolit obat prednison) dalam pengobatan kolitis ulserativa.
Hasil mereka didasarkan pada model organisme tikus; Meski begitu, ini merupakan harapan bagi para pasien yang juga menderita osteoporosis, karena mereka dapat menggunakan obat yang sama untuk memerangi kedua penyakit tersebut.
Hal ini digunakan untuk mensintesis strontium sulfat (SrSO 4 ), bahkan lebih padat dari SrCl 2 . Namun, kelarutannya yang minimal dalam air tidak membuatnya cukup ringan untuk dikegunaankan di bidang radiologi, tidak seperti barium sulfat (BaSO 4 ).
Persiapan strontium klorida
Strontium klorida dapat dibuat dengan aksi langsung asam klorida (HCl) pada logam murni, sehingga reaksi tipe redoks terjadi:
Sr (s) + HCl (aq) => SRCL 2 (aq) + H 2 (g)
Di sini, logam strontium dioksidasi dengan menyumbangkan dua elektron untuk memungkinkan pembentukan gas hidrogen.
Demikian juga, strontium hidroksida dan karbonat (Sr (OH) 2 dan SrCO 3 ) bereaksi dengan asam ini ketika mensintesisnya:
Sr (OH) 2 (s) + 2HCl (aq) => SrCl 2 (aq) + 2H 2 O (l)
SrCO 3 (s) + 2HCl (aq) => SrCl 2 (aq) + CO 2 (g) + H 2 O (l)
Dengan teknik kristalisasi, diperoleh SrCl 2 · 6H 2 O yang kemudian didehidrasi dengan aksi termal hingga akhirnya menghasilkan SrCl 2 anhidrat.
Sifat Strontium Klorida
Sifat fisik dan kimia senyawa ini tergantung pada apakah dalam bentuk terhidrasi atau anhidrat. Ini karena interaksi elektrostatik berubah ketika molekul air ditambahkan ke kisi kristal SrCl 2 .
anhidrat
Strontium klorida adalah padatan kristal putih, dengan berat molekul 158,53 g / mol, dan kepadatan 3,05 g / mL.
Titik lelehnya (874 C) dan titik didih (1250 C) tinggi, menunjukkan interaksi elektrostatik yang kuat antara ion Sr 2+ dan Cl – . Demikian juga, ia mencerminkan energi kisi kristal besar yang dimiliki struktur anhidratnya.
Entalpi pembentukan SrCl 2 padat adalah 828,85 KJ / mol. Ini mengacu pada energi panas yang dilepaskan oleh setiap mol yang terbentuk dari komponennya dalam keadaan standarnya: gas untuk klorin dan padat untuk strontium.
heksahidrat
Dalam bentuk heksahidrat, ia memiliki berat molekul lebih tinggi daripada bentuk anhidratnya (267 g / mol), dan kepadatan lebih rendah (1,96 g / mL). Penurunan kepadatan ini disebabkan oleh fakta bahwa molekul air “memperluas” kristal, meningkatkan volume; karenanya, kepadatan struktur berkurang.
Ini hampir dua kali lebih padat dari air pada suhu kamar. Kelarutannya dalam air sangat tinggi, tetapi dalam etanol sedikit larut. Ini karena karakter organiknya meskipun polaritasnya. Artinya, heksahidrat adalah senyawa anorganik polar. Akhirnya, pada 150 ° C didehidrasi untuk menghasilkan garam anhidrat:
SrCl 2 · 6H 2 O (s) => SrCl 2 (s) + 6H 2 O (g)
Referensi
- Wikipedia. (2018). Strontium klorida. Dipulihkan dari en.wikipedia.org
- Bank Obat. (2018). Strontium klorida Sr-89. Dipulihkan dari drugbank.ca
- Pubchem. (2018). Strontium Klorida. Dipulihkan dari pubchem.ncbi.nlm.nih.gov
- Banteng. ibu. (2010). Pengaruh granular strontium klorida sebagai aditif pada beberapa sifat listrik dan mekanik untuk alkohol polivinil murni. Sci., Vol.33, No.2, hlm. 149–155. Akademi Ilmu Pengetahuan India.
- koil. (4 September 2009). Strontium-klorida-xtal-3D-SF. [Angka]. Diakses pada 13 April 2018, dari: commons.wikimedia.org
- Semua reaksi. SrCl2 – Strontium Klorida. Dipulihkan dari allreactions.com