Valensi nitrogen mulai dari -3 sebagai amonia dan amina, untuk asam 5 dan nitrat (Tyagi, 2009). Unsur ini tidak memperluas valensi seperti yang lain.
Atom nitrogen adalah unsur kimia dengan nomor atom 7 dan unsur pertama golongan 15 (sebelumnya VA) dari tabel periodik. Gugus tersebut terdiri dari nitrogen (N), fosfor (P), arsenik (As), antimon (Sb), bismut (Bi), dan moscovium (Mc).

Gambar 1: Diagram Bohr atom nitrogen.
Unsur-unsur memiliki kesamaan umum tertentu dalam perilaku kimia, meskipun mereka jelas dibedakan satu sama lain secara kimiawi. Kesamaan ini mencerminkan ciri-ciri umum dari struktur elektronik atom mereka (Sanderson, 2016).
Nitrogen hadir di hampir semua protein dan memainkan peran penting dalam kegunaan biokimia dan industri. Nitrogen membentuk ikatan yang kuat karena kemampuannya untuk mengikat rangkap tiga dengan atom nitrogen lain dan unsur lainnya.
Oleh karena itu, ada sejumlah besar energi dalam senyawa nitrogen. Sebelum 100 tahun yang lalu, sedikit yang diketahui tentang nitrogen. Sekarang, nitrogen biasa digunakan untuk mengawetkan makanan, dan sebagai pupuk (Wandell, 2016).
Konfigurasi elektron dan valensi
Dalam atom, elektron mengisi tingkat yang berbeda sesuai dengan energi mereka. Elektron pertama mengisi tingkat energi yang lebih rendah dan kemudian pindah ke tingkat energi yang lebih tinggi.
Tingkat energi terluar dalam atom dikenal sebagai kulit valensi dan elektron yang ditempatkan di kulit ini dikenal sebagai elektron valensi.
Elektron ini terutama ditemukan dalam pembentukan ikatan dan reaksi kimia dengan atom lain. Oleh karena itu, elektron valensi bertanggung jawab atas sifat kimia dan fisik yang berbeda dari suatu unsur (Elektron Valensi, SF).
Nitrogen, seperti yang disebutkan sebelumnya, memiliki nomor atom Z = 7. Ini menyiratkan bahwa pengisian elektron dalam tingkat energinya, atau konfigurasi elektronnya, adalah 1S 2 2S 2 2P 3 .
Harus diingat bahwa di alam, atom selalu berusaha untuk memiliki konfigurasi elektron gas mulia, baik dengan mendapatkan, kehilangan atau berbagi elektron.
Dalam kasus nitrogen, gas mulia yang berusaha memiliki konfigurasi elektronik adalah neon, yang nomor atomnya adalah Z = 10 (1S 2 2S 2 2P 6 ) dan helium, yang nomor atomnya adalah Z = 2 (1S 2 ) ( Reusch, 2013).
Cara berbeda yang dimiliki nitrogen untuk menggabungkan akan memberikannya valensi (atau keadaan oksidasi). Dalam kasus khusus nitrogen, karena berada dalam periode kedua dari tabel periodik, ia tidak dapat memperluas kulit valensinya seperti yang dilakukan oleh unsur-unsur lain dalam golongannya.
Harapkan untuk memiliki valensi -3, +3, dan +5. Namun, nitrogen memiliki status valensi mulai dari -3, seperti pada amonia dan amina, hingga +5, seperti pada asam nitrat. (Tyagi, 2009).
Teori ikatan valensi membantu menjelaskan pembentukan senyawa, menurut konfigurasi elektron nitrogen untuk keadaan oksidasi tertentu. Untuk ini, perlu diperhitungkan jumlah elektron dalam kulit valensi dan berapa banyak yang tersisa untuk memperoleh konfigurasi gas mulia.
Senyawa nitrogen
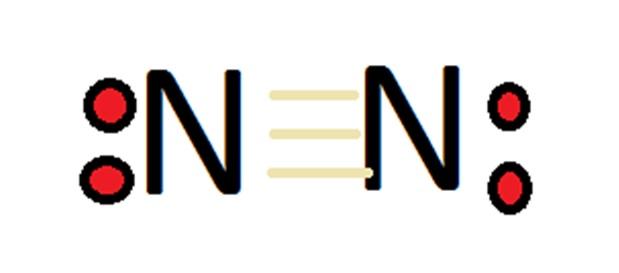
Gambar 2: struktur molekul nitrogen dengan valensi 0.
Mengingat jumlah bilangan oksidasinya yang besar, nitrogen dapat membentuk sejumlah besar senyawa. Dalam contoh pertama, harus diingat bahwa dalam kasus nitrogen molekuler, menurut definisi valensinya adalah 0.
Tingkat oksidasi -3 adalah salah satu yang paling umum untuk elemen. Contoh senyawa dengan keadaan oksidasi ini adalah amonia (NH3), amina (R3N), ion amonium (NH 4 + ), imina (C = NR) dan nitril (C≡N).
Dalam keadaan oksidasi -2, nitrogen dibiarkan dengan 7 elektron di kulit valensinya. Jumlah elektron ganjil dalam kulit valensi ini menjelaskan mengapa senyawa dengan tingkat oksidasi ini memiliki ikatan penghubung antara dua nitrogen. Contoh senyawa dengan keadaan oksidasi ini adalah hidrazin (R 2 -NNR 2 ) dan hidrazon (C = NNR 2 ).
Dalam keadaan oksidasi -1, nitrogen dibiarkan dengan 6 elektron di kulit valensi. Contoh senyawa nitrogen dengan valensi ini adalah hidroksil amina (R 2 NOH) dan senyawa azo (RN = NR).
Dalam keadaan oksidasi positif, nitrogen umumnya melekat pada atom oksigen untuk membentuk oksida, oxysalts, atau oxacids. Untuk kasus keadaan oksidasi +1, nitrogen memiliki 4 elektron di kulit valensinya.
Contoh senyawa dengan valensi ini adalah dinitrogen oksida atau gas tertawa (N 2 O) dan senyawa nitroso (R = NO) (Reusch, Oxidation States of Nitrogen, 2015).
Untuk kasus keadaan oksidasi +2, contohnya adalah nitrogen oksida atau oksida nitrat (NO), gas tidak berwarna yang dihasilkan oleh reaksi logam dengan asam nitrat encer. Senyawa ini merupakan radikal bebas yang sangat tidak stabil karena bereaksi dengan O 2 di udara membentuk gas NO 2 .
Nitrit (NO 2 – ) dalam larutan basa dan asam nitrat (HNO 2 ) dalam larutan asam adalah contoh senyawa dengan bilangan oksidasi +3. Ini dapat menjadi agen pengoksidasi untuk biasanya menghasilkan NO (g) atau agen pereduksi untuk membentuk ion nitrat.
Dinitrogen trioksida (N 2 O 3 ) dan gugus nitro (R-NO 2 ) adalah contoh lain dari senyawa nitrogen dengan valensi +3.
Nitrat dioksida (NO 2 ) atau nitrogen dioksida adalah senyawa nitrogen dengan valensi +4. Ini adalah gas coklat yang umumnya dihasilkan oleh reaksi asam nitrat pekat dengan banyak logam. Dimerisasi membentuk N 2 O 4 .
Dalam keadaan +5 kita menemukan nitrat dan asam nitrat, yang merupakan agen pengoksidasi dalam larutan asam. Dalam hal ini, nitrogen memiliki 2 elektron di kulit valensi, yang berada di orbital 2S. (Keadaan oksidasi nitrogen, SF).
Ada juga senyawa seperti nitrosilazide dan dinitrogen trioksida di mana nitrogen memiliki berbagai tingkat oksidasi dalam molekulnya. Dalam kasus nitrosilazide (N 4 O), nitrogen memiliki valensi -1, 0, + 1 dan +2; dan dalam kasus dinitrogen trioksida, ia memiliki valensi +2 dan +4.
Tata nama senyawa nitrogen
Mengingat kompleksitas kimia senyawa nitrogen, penamaan tradisional tidak cukup untuk menamai mereka, apalagi mengidentifikasi mereka dengan benar. Itulah sebabnya, antara lain, bahwa International Union of Pure and Applied Chemistry (IUPAC) membuat tata nama sistematis di mana senyawa diberi nama sesuai dengan jumlah atom yang dikandungnya.
Ini bermanfaat dalam hal penamaan nitrogen oksida. Misalnya oksida nitrat akan diberi nama nitrogen monoksida dan nitrous oksida (NO) dinitrogen monoksida (N 2 O).
Selain itu, pada tahun 1919, ahli kimia Jerman Alfred Stock mengembangkan metode penamaan senyawa kimia berdasarkan keadaan oksidasi, yang ditulis dalam angka Romawi yang diapit tanda kurung. Jadi, misalnya oksida nitrat dan oksida nitrat masing-masing akan disebut nitrogen oksida (II) dan nitrogen oksida (I) (IUPAC, 2005).
Referensi
- (2005). NOMENKLATUR KIMIA ANORGANIK Rekomendasi IUPAC 2005. Diperoleh dari iupac.org.
- Keadaan oksidasi nitrogen (SF). Dipulihkan dari kpu.ca.
- Reusch, W. (2013, 5 Mei). Konfigurasi Elektron pada Tabel Periodik . Dipulihkan dari chemistry.msu.edu.
- Reusch, W. (2015, 8 Agustus). Keadaan Oksidasi Nitrogen . Dipulihkan dari chem.libretexts.org.
- Sanderson, RT (2016, 12 Desember). Unsur golongan nitrogen . Dipulihkan dari britannica.com.
- Tyagi, Wakil Presiden (2009). Kimia Esensial Xii. Deli Baru: Ratna Sagar.
- Elektron Valensi . (SF). Dipulihkan dari chemistry.tutorvista.com.
- Wandell, A. (2016, 13 Desember). Kimia Nitrogen . Dipulihkan dari chem.libretexts.org.