Kami menjelaskan apa itu alkohol, klasifikasi, nomenklatur, dan sifat-sifatnya. Juga, contoh dan pentingnya dalam industri.
Apa itu alkohol?
Alkohol adalah senyawa kimia organik tertentu, yang dalam strukturnya memiliki satu atau lebih gugus kimia hidroksil (-OH) yang terikat secara kovalen dengan atom karbon jenuh (yaitu, dengan ikatan tunggal hanya pada atom yang berdekatan), membentuk gugus karbinol ( -C- OH).
Alkohol merupakan senyawa organik yang sangat umum di alam, yang memainkan peran penting dalam organisme hidup, terutama dalam sintesis organik.
Namanya berasal dari bahasa Arab al-kukhūl, yang secara harfiah diterjemahkan sebagai “roh”, spirit atau “cairan sulingan.” Ini karena para alkemis Muslim kuno menyebut alkohol sebagai “roh” dan selanjutnya menyempurnakan metode penyulingan pada abad ke-9. Studi selanjutnya memungkinkan untuk mengetahui sifat kimia dari senyawa ini, terutama kontribusi Lavoisier mengenai fermentasi ragi bir.
Alkohol dapat menjadi racun dan bahkan mematikan bagi tubuh manusia jika tertelan dalam dosis tinggi. Selain itu, ketika dikonsumsi oleh manusia, mereka dapat bertindak sebagai depresan sistem saraf pusat, menyebabkan keracunan dan menyebabkan perilaku yang lebih bebas dari biasanya.
Di sisi lain, alkohol memiliki sifat antibakteri dan antiseptik yang memungkinkan penggunaannya dalam industri kimia dan obat-obatan.
Jenis-jenis alkohol
Alkohol dapat diklasifikasikan menurut jumlah gugus hidroksil yang ada dalam strukturnya:
Monoalkohol atau alkohol. Ini mengandung satu gugus hidroksil. Sebagai contoh:
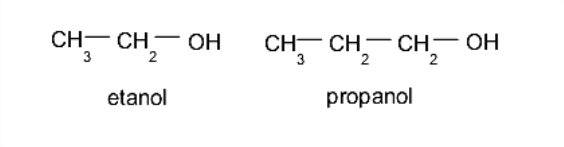
Polialkohol atau poliol. Mereka mengandung lebih dari satu gugus hidroksil. Sebagai contoh:
Cara lain untuk mengklasifikasikan alkohol adalah menurut posisi karbon yang mengikat gugus hidroksil, juga dengan mempertimbangkan berapa banyak atom karbon yang juga melekat pada karbon ini:
Alkohol primer. Gugus hidroksil (-OH) terletak pada karbon yang dihubungkan secara bergantian dengan atom karbon tunggal lainnya. Sebagai contoh:
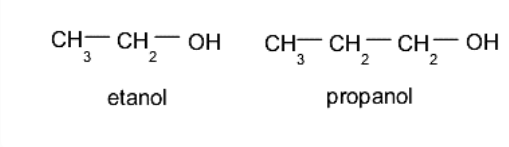
Alkohol sekunder. Gugus hidroksil (-OH) terletak pada karbon yang terikat pada dua atom karbon lain yang berbeda. Sebagai contoh:
Alkohol tersier. Gugus hidroksil (-OH) terletak pada karbon yang dihubungkan secara bergantian dengan tiga atom karbon lain yang berbeda. Sebagai contoh:
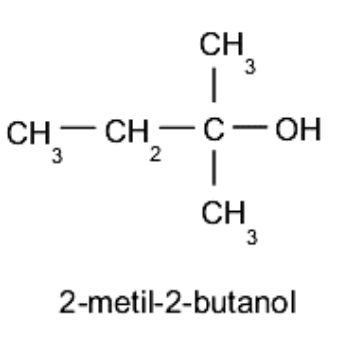
Tata nama alkohol
Seperti senyawa organik lainnya, alkohol memiliki nama yang berbeda, yang akan kami jelaskan di bawah ini:
- Cara tradisional (non-sistemik). Perhatian diberikan, pertama-tama, pada rantai karbon yang melekat pada hidroksil (umumnya alkana), untuk menyelamatkan istilah yang menamakannya, tambahkan kata “alkohol” dan kemudian tambahkan akhiran -il sebagai ganti – ana. Sebagai contoh:
- Jika itu adalah rantai metana, ini akan disebut metil alkohol.
- Jika itu adalah rantai etana, itu akan disebut etil alkohol.
- Jika itu adalah rantai propana, itu akan disebut propil alkohol.
- Metode IUPAC. Seperti metode sebelumnya, perhatian akan diberikan pada prekursor hidrokarbon, untuk menyelamatkan namanya dan cukup tambahkan akhiran -ol sebagai ganti -ana. Sebagai contoh:
- Jika itu adalah rantai metana, itu akan disebut metanol.
- Jika itu adalah rantai etana, itu akan disebut etanol.
- Jika itu adalah rantai propana, itu akan disebut propanol.
Akhirnya, akan perlu untuk menunjukkan dalam beberapa cara lokasi gugus hidroksil dalam rantai, yang nomornya digunakan di awal namanya. Penting untuk dicatat bahwa rantai hidrokarbon terpanjang selalu dipilih sebagai rantai primer dan posisi gugus hidroksil harus dipilih menggunakan penomoran sesedikit mungkin. Misalnya: 2-butanol.
Sifat fisik alkohol
Alkohol umumnya adalah cairan tidak berwarna yang menimbulkan bau yang khas, meskipun juga, dengan kelimpahan yang lebih sedikit, mereka dapat berada dalam keadaan padat. Mereka larut dalam air karena gugus hidroksil (-OH) memiliki kesamaan tertentu dengan molekul air (H2O), yang memungkinkan mereka untuk membentuk ikatan hidrogen. Dalam pengertian ini, alkohol yang paling larut dalam air adalah alkohol dengan massa molekul terendah, yaitu alkohol dengan struktur yang lebih kecil dan sederhana. Ketika jumlah atom karbon meningkat dan kompleksitas rantai karbon meningkat, semakin sedikit alkohol yang larut dalam air.
Kepadatan alkohol lebih tinggi sesuai dengan peningkatan jumlah atom karbon dan cabang-cabang rantai hidrokarbonnya. Di sisi lain, pembentukan ikatan hidrogen tidak hanya mempengaruhi kelarutan, tetapi juga titik leleh dan titik didihnya. Semakin besar rantai hidrokarbon, semakin banyak gugus hidroksil yang dimilikinya dan semakin banyak cabang yang dimilikinya, semakin tinggi nilai kedua sifat tersebut.
Sifat kimia alkohol
Alkohol memiliki karakter dipolar, mirip dengan air, karena gugus hidroksilnya. Hal ini membuat mereka zat polar (dengan kutub positif dan negatif).
Karena itu, alkohol dapat berperilaku sebagai asam atau basa tergantung pada reaktan mana mereka bereaksi. Misalnya, jika alkohol direaksikan dengan basa kuat, gugus hidroksil terdeprotonasi dan oksigen mempertahankan muatan negatifnya, bertindak seperti asam.
Sebaliknya, jika alkohol dihadapkan dengan asam yang sangat kuat, pasangan elektron oksigen menyebabkan gugus hidroksil terprotonasi, memperoleh muatan positif dan berperilaku sebagai basa lemah.
Di sisi lain, alkohol dapat berpartisipasi dalam reaksi kimia berikut:
Halogenasi. Alkohol bereaksi dengan hidrogen halida menghasilkan alkil halida dan air. Alkohol tersier bereaksi lebih mudah daripada alkohol primer dan sekunder. Beberapa contoh reaksi tersebut adalah:
Oksidasi. Alkohol teroksidasi ketika bereaksi dengan senyawa pengoksidasi tertentu, membentuk produk yang berbeda tergantung pada jenis alkohol yang dioksidasi (primer, sekunder atau tersier). Sebagai contoh:
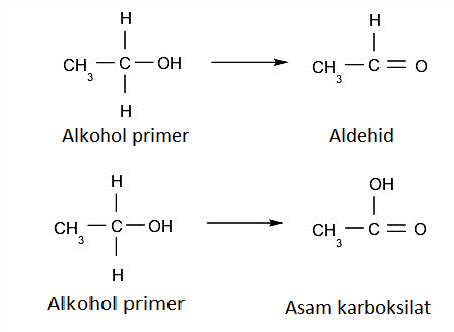
- Alkohol primer. Mereka terjadi jika, ketika teroksidasi, mereka kehilangan atom hidrogen yang melekat pada karbon, yang pada gilirannya melekat pada gugus hidroksil, mereka membentuk aldehida. Di sisi lain, jika mereka kehilangan dua atom hidrogen dari karbon ini, mereka membentuk asam karboksilat.
- Alkohol sekunder. Saat mereka mengoksidasi, mereka kehilangan satu-satunya atom hidrogen yang terikat karbon yang memiliki gugus hidroksil dan membentuk keton.
- Alkohol tersier. Mereka tahan terhadap oksidasi, yaitu, mereka tidak berkarat, kecuali jika kondisi yang sangat spesifik dikenakan pada mereka.
Dehidrogenasi. Alkohol (hanya primer dan sekunder) ketika mengalami suhu tinggi dan dengan adanya katalis tertentu, kehilangan hidrogen untuk membentuk aldehida dan keton.
Dehidrasi. Ini terdiri dari menambahkan asam mineral ke alkohol untuk mengekstrak gugus hidroksil dan mendapatkan alkena yang sesuai melalui proses eliminasi.
Pentingnya alkohol
Alkohol adalah zat dengan nilai kimia yang besar. Sebagai bahan baku, mereka digunakan untuk mendapatkan senyawa organik lainnya di laboratorium. Juga sebagai komponen produk industri sehari-hari, seperti desinfektan, pembersih, pelarut, dasar parfum.
Alkohor juga bermanfaat dalam pembuatan bahan bakar, terutama di industri biofuel, alternatif yang berasal dari fosil. Adalah umum untuk melihat mereka di rumah sakit, kotak P3K atau sejenisnya.
Di sisi lain, alkohol tertentu adalah untuk konsumsi manusia (terutama etanol), bagian dari banyak alkohol dalam berbagai tingkat kehalusan dan intensitas.
Contoh alkohol
Beberapa contoh alkohol yang banyak digunakan setiap hari adalah:
- metanol atau metil alkohol (CH3OH)
- etanol atau etil alkohol (C2H5OH)
- 1-propanol, propanol, atau propil alkohol (C3H7OH)
- isobutanol (C4H9OH)