Asam karboksilat adalah senyawa organik, biasanya hidrokarbon, memiliki di salah satu setidaknya gugus fungsional karboksil (-COOH). Satu lagi contoh asam karboksilat adalah asam format atau asam metanoat yang rumusnya adalah HCOOH.
Asam karboksilat merupakan serangkaian homolog di mana senyawa mengandung gugus fungsional yang disebut gugus karboksil (-COOH). Rumus molekuler umum untuk asam karboksilat adalah CnH2n + 1COOH. Asam karboksilat mengandung setidaknya satu gugus karboksil.
Asam karboksilat dengan dua atau lebih gugus karboksil yang melekat disebut asam dikarboksilat, asam trikarboksilat, dll. Asam karboksilat adalah turunan dari hidrokarbon di mana satu atau lebih atom hidrogen dalam hidrokarbon telah digantikan oleh gugus karboksil. Empat asam karboksilat pertama yang berasal dari alkana adalah asam metanoat (HCOOH), asam etanoat (CH3COOH), asam propanoat (C2H5COOH) dan asam butanoat (C3H7COOH).
Pengertian
Asam karboksilat adalah gugus fungsi paling penting yang menunjukkan ikatan rangkap C = O. Jenis senyawa organik ini dapat diperoleh dengan rute yang berbeda, beberapa asam karboksilat, seperti asam sitrat, asam laktat atau asam fumarat dihasilkan dari fermentasi, sebagian besar asam karboksilat jenis ini diterapkan dalam industri makanan.
Gugus karboksil (COOH) adalah gugus fungsi yang terdiri dari gugus karbonil (C = O) dengan gugus hidroksil (O-H) yang terikat pada atom karbon yang sama. Gugus karboksil memiliki rumus -C (= O) OH, biasanya ditulis sebagai -COOH atau CO2H. Asam karboksilat adalah kelas molekul yang dicirikan dengan adanya satu gugus karboksil. Sebagai donor proton, asam karboksilat dikarakterisasi sebagai asam Brønsted-Lowry. Asam dengan dua atau lebih gugus karboksilat disebut dikarboksilat, trikarboksilat, dll. Garam dan ester dari asam karboksilat disebut karboksilat. Ion karboksilat distabilkan oleh resonansi. Peningkatan stabilitas ini menyebabkan peningkatan keasaman dibandingkan dengan alkohol.
Asam karboksilat bertindak sebagai akseptor ikatan hidrogen, karena gugus karbonil, dan donor ikatan hidrogen, karena gugus hidroksil. Akibatnya, mereka sering berpartisipasi dalam ikatan hidrogen. Asam karboksilat biasanya ada sebagai pasangan dimer di media nonpolar karena kecenderungannya untuk “berasosiasi sendiri”.
Kecenderungan ikatan hidrogen ini memberi mereka stabilitas yang meningkat serta titik didih yang lebih tinggi relatif terhadap asam dalam larutan air. Asam karboksilat adalah molekul polar; mereka cenderung larut dalam air, tetapi seiring dengan semakin panjangnya rantai alkil, kelarutannya menurun karena meningkatnya sifat hidrofobik dari rantai karbon.
Asam karboksilat dicirikan sebagai asam lemah, yang berarti bahwa asam karboksilat tidak sepenuhnya berdisosiasi untuk menghasilkan kation H + dalam larutan berair netral.
Struktur Asam Karboksilat
Rumus umum dari asam karboksilat adalah R-COOH, adalah COOH mengacu pada gugus karboksil, dan R mengacu pada sisa molekul tempat kelompok ini melekat. Dalam gugus karboksil ini, ada karbon yang berbagi ikatan rangkap dengan atom oksigen dan ikatan tunggal dengan gugus hidroksil.
Struktur umum asam karboksilat diilustrasikan di bawah ini.
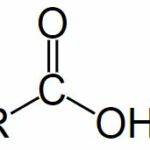
Dari ilustrasi yang diberikan di atas, dapat diamati bahwa asam karboksilat mengandung gugus hidroksil yang terikat pada karbon karbonil. Karena keelektronegatifan atom oksigen, gugus fungsional ini dapat mengalami ionisasi dan melepaskan proton.
Ion karboksilat, dihasilkan dari penghilangan proton dari gugus karboksil, distabilkan dengan adanya dua atom oksigen (yang melaluinya muatan negatif dapat bergerak). Beberapa contoh umum asam karboksilat termasuk asam asetat (komponen cuka) dan asam format.
Tata nama Asam Karboksilat
Secara umum, senyawa organik ini disebut dengan nama alkana mereka, yang mengandung akhiran “-oat”. Contoh nama yang untuk asam karboksilat adalah asam asetat (CH3COOH). Dalam nomenklatur IUPAC dari senyawa-senyawa ini, sufiks “-oat” diberikan.
Pedoman yang harus diikuti dalam nomenklatur IUPAC asam karboksilat tercantum di bawah ini.
- Akhiran “a” atas nama alkana yang sesuai diganti dengan “asam oat”.
- Ketika rantai alifatik hanya mengandung satu gugus karboksil, karbon karboksilat selalu bernomor satu. Sebagai contoh, CH3COOH disebut sebagai asam etanoat.
- Ketika rantai alifatik mengandung lebih dari satu gugus karboksil, jumlah total atom karbon dihitung dan jumlah gugus karboksil diwakili oleh awalan angka Yunani seperti “di-“, “tri-“, dll.
- Asam karboksilat dinamai dengan menambahkan awalan dan sufiks ini ke rantai alkil induk. Angka Arab digunakan untuk menunjukkan posisi gugus karboksil.
- Nama “asam karboksilat” atau “karboksilat” juga dapat ditetapkan untuk substituen karboksil pada rantai karbon. Contoh dari nomenklatur tersebut adalah nama 2-karbofuran untuk senyawa Asam 2-Furoic.
Contoh Asam Karboksilat
Beberapa contoh asam karboksilat disediakan di bawah ini.
- CH 3 COOH, asam asetat atau etanoat (ditemukan dalam cuka)
- HOOC-COOH, asam etanoat, juga disebut asam oksalat,
- CH 3 CH 2 COOH, asam propanoat
- C 6 H 5 COOH, asam benzoat (natrium benzoat, garam natrium dari asam benzoat digunakan sebagai pengawet)
- Asam laktat
- Asam amino: mengandung gugus karboksil dan gugus amino.
- Asam lemak: semuanya adalah asam karboksilat.
- Sianoakrilat
- Asam benzoat
- Asam asetilsalisilat
- Asam sitrat
Sifat Asam Karboksilat
Sebagian besar sifat asam karboksilat adalah hasil dari keberadaan gugus karboksil. Beberapa sifat fisik dan kimia dari senyawa ini dibahas dalam paragraf ini.
Sifat Fisik Asam Karboksilat:
- Molekul asam karboksilat adalah polar karena adanya dua atom oksigen elektronegatif.
Mereka juga berpartisipasi dalam ikatan hidrogen karena keberadaan gugus karbonil (C = O) dan gugus hidroksil. - Ketika ditempatkan dalam pelarut nonpolar, senyawa ini membentuk dimer melalui ikatan hidrogen antara gugus hidroksil dari satu asam karboksilat dan gugus karbonil yang lain.
Dimers dari Asam Carboxylic - Kelarutan senyawa yang mengandung gugus fungsi karboksil dalam air tergantung pada ukuran senyawa. Semakin kecil senyawa (semakin pendek kelompok R), semakin tinggi kelarutannya.
- Titik didih asam karboksilat umumnya lebih tinggi dari air.
- Senyawa ini memiliki kemampuan untuk menyumbangkan proton dan karena itu asam Bronsted-Lowry.
- Mereka umumnya memiliki bau asam yang kuat. Namun, ester mereka memiliki bau yang menyenangkan dan karenanya digunakan dalam parfum.
Sifat Kimia Asam Karboksilat:
- Karbon α milik asam karboksilat dapat dengan mudah dihalogenasi melalui reaksi Hell-Volhard-Zelinsky.
- Senyawa ini dapat diubah menjadi amina menggunakan reaksi Schmidt.
- Asam karboksilat dapat direduksi menjadi alkohol dengan memperlakukannya dengan hidrogen untuk menyebabkan reaksi hidrogenasi.
- Setelah bereaksi dengan alkohol, senyawa ini menghasilkan ester.
Kegunaan Asam Karboksilat
- Asam lemak yang penting bagi manusia terdiri dari asam karboksilat. Contohnya termasuk asam lemak omega-6 dan omega-3.
- Asam lemak yang lebih tinggi juga digunakan dalam pembuatan sabun.
- Produksi minuman ringan dan banyak produk makanan lainnya melibatkan penggunaan banyak asam karboksilat.
- Pembuatan karet melibatkan penggunaan asam asetat sebagai koagulan.
- Asam heksanedioat digunakan dalam pembuatan nilon-6,6.
- Asam karboksilat memiliki banyak aplikasi dalam industri karet, tekstil, dan kulit.
- Asam etilenadiaminatetraasetat adalah agen pengkelat yang banyak digunakan. Sintesis banyak obat melibatkan penggunaan senyawa ini. Karena itu, asam karboksilat sangat penting dalam obat-obatan.
- Produksi banyak polimer melibatkan penggunaan senyawa yang mengandung gugus fungsi karboksil.
Dengan demikian, rumus umum, struktur, nomenklatur, sifat, dan penggunaan asam karboksilat dibahas secara singkat. Untuk mempelajari lebih lanjut tentang senyawa ini dan jenis senyawa organik lainnya, seperti aldehida dan keton, daftar dengan BYJU dan unduh aplikasi seluler pada ponsel cerdas Anda.
Spektroskopi Asam Karboksilat
Asam karboksilat dapat dikarakterisasi dengan spektroskopi IR; mereka menunjukkan pita tajam yang terkait dengan getaran ikatan C-O antara 1680 dan 1725 cm-1. Selain itu, puncak lebar muncul di wilayah 2500 hingga 3000 cm-1. Dengan spektroskopi 1H NMR, hidrogen hidroksil muncul di wilayah 10-13 ppm, meskipun sering diperluas atau tidak diamati karena pertukaran dengan jejak air.
Reaktivitas Asam Karboksilat
Asam karboksilat digunakan dalam produksi polimer, farmasi, pelarut, dan aditif makanan. Karenanya, mereka sering kali diproduksi secara industri dalam skala besar. Asam karboksilat umumnya dihasilkan dari oksidasi aldehida dan hidrokarbon, dan dehidrogenasi alkohol yang dikatalisis oleh basa. Mereka dapat diproduksi di laboratorium untuk reaksi skala kecil melalui oksidasi alkohol primer atau aldehida, pembelahan oksidatif olefin, dan melalui hidrolisis nitril, ester, atau amida.
Asam karboksilat banyak digunakan sebagai prekursor untuk menghasilkan senyawa lain. Setelah terpapar basa, asam karboksilat terdeprotonasi dan membentuk garam karboksilat. Mereka juga bereaksi dengan alkohol untuk menghasilkan ester dan dapat mengalami reaksi reduksi dengan hidrogenasi atau penggunaan zat pereduksi. Ada juga berbagai reaksi khusus yang melibatkan asam karboksilat yang mengarah pada pembentukan amina, aldehida, dan keton.