Berilium oksida (BeO) adalah bahan keramik, di samping kekuatan tinggi dan resistivitas listrik, memiliki kemampuan mengemudi panas tinggi seperti yang membuat bagian dari reaktor nuklir, bahkan melampaui logam di sifat yang terakhir.
Selain kegunaannya sebagai bahan sintetis, juga dapat ditemukan di alam, meskipun jarang. Penanganannya harus dilakukan dengan hati-hati, karena berpotensi merusak kesehatan manusia secara serius.
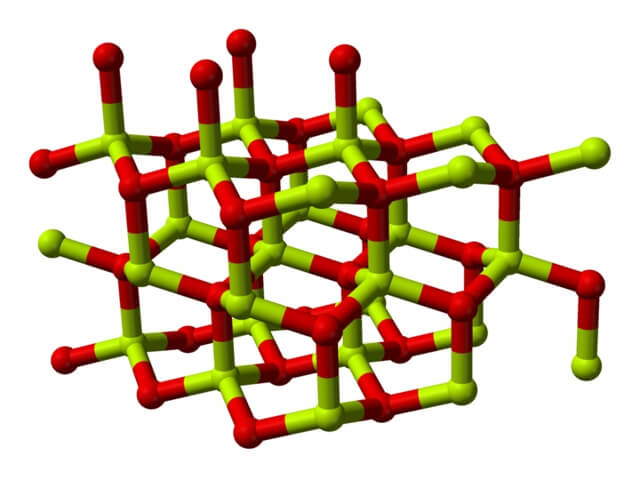
Model struktur kristal berilium oksida, Oleh Ben Mills [Domain publik], dari Wikimedia Commons
Di dunia cararn, telah diamati bagaimana para ilmuwan yang terkait dengan perusahaan teknologi telah melakukan penelitian untuk mengembangkan bahan canggih untuk kegunaan yang cukup khusus, seperti yang memenuhi bahan semikonduktor dan industri kedirgantaraan.
Hasilnya adalah penemuan zat yang, berkat sifatnya yang sangat berguna dan daya tahan tinggi, telah memberi kita kesempatan untuk bergerak maju dalam waktu, memungkinkan kita untuk membawa teknologi kita ke tingkat yang lebih tinggi.
Struktur kimia Berilium oksida
Molekul berilium oksida (juga disebut “berilium”) terdiri dari atom berilium dan atom oksigen, keduanya terkoordinasi dalam orientasi tetrahedral, dan mengkristal menjadi struktur kristal heksagonal yang disebut wurtzites.
Kristal ini memiliki pusat tetrahedral, yang ditempati oleh Be 2+ dan O 2- . Pada suhu tinggi, struktur berilium oksida menjadi tipe tetragonal.
Memperoleh berilium oksida dicapai dengan tiga metode: kalsinasi berilium karbonat, dehidrasi berilium hidroksida, atau dengan pengapian berilium logam. Berilium oksida yang terbentuk pada suhu tinggi bersifat inert, tetapi dapat dilarutkan oleh berbagai senyawa.
BeCO 3 + Panas → BeO + CO 2 (Kalsinasi)
Be (OH) 2 → BeO + H 2 O (Dehidrasi)
2 Be + O 2 → 2 BeO (Pengapian)
Akhirnya, berilium oksida dapat diuapkan, dan dalam keadaan ini akan berbentuk molekul diatomik.
Sifat Berilium oksida
Berilium oksida terjadi di alam sebagai bromellit, mineral putih yang ditemukan di beberapa deposit besi mangan kompleks, tetapi paling sering ditemukan dalam bentuk sintetisnya: padatan amorf putih yang berbentuk bubuk..
Juga, kotoran yang terperangkap selama produksi akan memberikan sampel oksida warna yang bervariasi.
Titik lelehnya terletak pada 2507 C, titik didihnya pada 3900 C, dan memiliki massa jenis 3,01 g / cm 3 .
Dengan cara yang sama, stabilitas kimianya sangat tinggi, hanya bereaksi dengan uap air pada suhu mendekati 1000 C, dan dapat menahan proses reduksi karbon dan serangan logam cair pada suhu tinggi.
Selain itu, kekuatan mekaniknya cukup baik, dan dapat ditingkatkan dengan desain dan pembuatan yang cocok untuk penggunaan komersial.
Konduktivitas listrik
Berilium oksida adalah bahan keramik yang sangat stabil, dan oleh karena itu memiliki resistivitas listrik yang cukup tinggi yang menjadikannya salah satu bahan isolasi listrik terbaik, bersama dengan alumina.
Karena itu, bahan ini biasanya digunakan untuk peralatan listrik frekuensi tinggi khusus.
Konduktivitas termal
Berilium oksida memiliki keunggulan besar dalam hal konduktivitas termal: ia dikenal sebagai bahan penghantar panas terbaik kedua di antara non-logam, setelah intan, bahan yang jauh lebih mahal dan langka.
Sedangkan untuk logam, hanya tembaga dan perak yang mentransfer panas lebih baik melalui konduksi daripada berilium oksida, menjadikannya bahan yang sangat diinginkan.
Karena sifat penghantar panasnya yang sangat baik, zat ini telah terlibat dalam produksi bahan tahan api.
Sifat optik
Karena sifat kristalnya, berilium oksida digunakan untuk kegunaan bahan transparan ultraviolet di layar datar tertentu dan sel fotovoltaik.
Demikian pula, kristal berkualitas sangat tinggi dapat diproduksi, sehingga sifat-sifat ini meningkat tergantung pada proses pembuatan yang digunakan.
Resiko kesehatan
Berilium oksida adalah senyawa yang harus ditangani dengan sangat hati-hati, karena terutama memiliki sifat karsinogenik, yang dikaitkan dengan penghirupan debu atau uap bahan ini secara terus menerus.
Partikel kecil dalam fase oksida ini menempel pada paru-paru, dan dapat menyebabkan pembentukan tumor atau penyakit yang dikenal sebagai berilliosis.
Beriliosis adalah penyakit dengan tingkat kematian sedang yang menyebabkan pernapasan tidak efisien, batuk, penurunan berat badan dan demam, serta pembentukan granuloma di paru-paru atau organ lain yang terkena.
Ada juga bahaya kesehatan dari kontak langsung berilium oksida dengan kulit, karena bersifat korosif dan mengiritasi, dan dapat menyebabkan kerusakan pada permukaan kulit dan selaput lendir. Saluran pernapasan dan tangan harus dilindungi saat bekerja dengan bahan ini, terutama dalam bentuk bubuk.
Kegunaan Berilium oksida
Penggunaan berilium oksida terutama dibagi menjadi tiga: kegunaan elektronik, nuklir dan lainnya.
Kegunaan elektronik
Kemampuan untuk mentransfer panas pada tingkat tinggi dan resistivitas listrik yang baik telah membuat berilium oksida sangat berguna sebagai penyerap panas.
Penggunaannya telah dibuktikan di sirkuit dalam komputer berkapasitas tinggi, serta peralatan yang menangani arus listrik yang tinggi.
Berilium oksida transparan terhadap sinar-X dan gelombang mikro, sehingga digunakan di jendela untuk melawan jenis radiasi ini, serta antena, sistem komunikasi, dan oven gelombang mikro.
Kegunaan nuklir
Kemampuannya untuk mecararasi neutron dan mempertahankan strukturnya di bawah bombardir radiasi telah menyebabkan berilium oksida terlibat dalam konstruksi reaktor nuklir, dan juga dapat diterapkan dalam reaktor berpendingin gas bersuhu tinggi.
Kegunaan lain
Kepadatan berilium oksida yang rendah telah membangkitkan minat dalam industri teknologi kedirgantaraan dan militer, karena dapat mewakili opsi berbobot rendah pada mesin roket dan rompi antipeluru.
Akhirnya, baru-baru ini diterapkan sebagai bahan tahan api dalam peleburan logam di industri metalurgi.
Referensi
- PubChem. (sf). Berilium Oksida. Diperoleh dari pubchem.ncbi.nlm.nih.gov
- Baca. (sf). Berilia / Berilium Oksida (BeO). Dipulihkan dari reade.com
- Penelitian, C. (sf). Berilium Oksida – Berilia. Diperoleh dari azom.com
- Layanan, NJ (sf). Berilium Oksida. Dipulihkan dari nj.gov
- Wikipedia. (sf). Berilium Oksida. Diperoleh dari en.wikipedia.org