Elektrofil adalah setiap spesies kimia (atom atau molekul) yang bersemangat mencari sepasang elektron. Kata itu berarti ‘cinta akan elektron’. Oleh karena itu, seorang elektrofil akan selalu cenderung untuk mendapatkan atau menerima elektron ketika berpartisipasi dalam reaksi kimia.
Apa yang membuat seorang elektrofil membutuhkan elektron? Itu harus memiliki kekurangan elektron, baik dimanifestasikan oleh muatan positif parsial atau total, atau oleh produk kekosongan elektronik dari oktet valensi yang tidak lengkap. Artinya, kita memiliki beberapa jenis elektrofil, meskipun mereka semua menerima pasangan elektron dari spesies negatif.
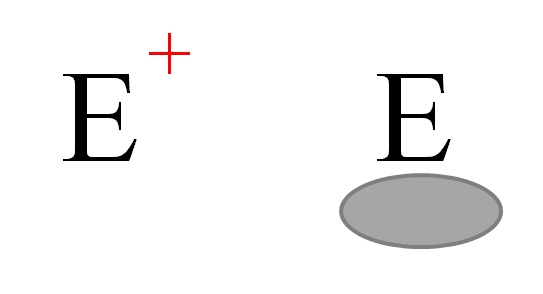
Dua jenis elektrofil yang paling umum dalam kimia. Sumber: Gabriel Bolivar.
Dua jenis elektrofil umumnya diwakili di atas. Keduanya dilambangkan dengan huruf E. Yang di sebelah kiri sesuai dengan elektrofil bermuatan positif, E + . Sementara itu, yang di sebelah kanan sesuai dengan elektrofil dengan kekosongan elektronik, diwakili oleh oval keabu-abuan yang menunjukkan tidak adanya elektron dalam orbital valensi.
Kation logam adalah contoh elektrofil E + , serta beberapa ion poliatomik seperti hidronium, H 3 O + . Molekul AlH 3 dan BF 3 , di sisi lain, adalah contoh dari jenis elektrofil kedua, karena baik atom aluminium dan atom boron memiliki kekurangan elektron karena mereka tidak melengkapi oktet valensi.
Reaksi
Elektrofil bereaksi dengan menerima pasangan elektron dari atom dengan kerapatan negatif yang tinggi, yaitu kaya akan elektron. Atom atau molekul negatif ini disebut nukleofil, Nu – , yang menyumbangkan sepasang elektron ke elektrofil E atau E + :
Nu – + E + → Nu-E
Ini adalah dasar teoretis untuk banyak reaksi organik, seperti substitusi aromatik elektrofilik. Nukleofil tidak harus berupa anion, tetapi juga dapat berupa molekul netral dengan atom elektronegatif, seperti nitrogen.
Contoh Elektrofil
Asam Lewis
Asam Lewis adalah elektrofil, karena menurut definisi mereka menerima pasangan elektron. Kation logam, M n + , menarik daerah negatif dari molekul polar tetangga dalam proses solvasi. Jadi, M n + berakhir mengelilingi dirinya dengan muatan negatif, bahkan menerima elektron untuk membentuk kompleks koordinasi.
Kation Cu 2+ , misalnya, adalah asam Lewis dan elektrofil karena berkoordinasi dengan atom oksigen dalam air untuk membentuk kompleks berair, Cu (OH 2 ) 6 2+ . Hal yang sama terjadi dengan kation lainnya.
Tidak semua asam Lewis adalah kation: beberapa adalah molekul atau atom netral. Misalnya, BF 3 adalah asam Lewis dan elektrofil karena berusaha menerima elektron dari spesies negatif terdekat untuk melengkapi oktet valensinya.
Dengan demikian, ia akan mengikat anion fluorida tetangga untuk membentuk anion boron tetrafluorida, BF 4 – . Artinya, BF 3 membentuk ikatan dengan F – dengan menerima sepasang elektronnya.
Elektrofil lain adalah ion nitronium, NO 2 + , yang merupakan agen elektrofilik yang sangat kuat yang terbentuk dalam reaksi nitrasi benzena. Dalam ion ini, atom nitrogen memiliki muatan positif, sehingga dengan cepat menerima elektron dari benzena.
Asam Bronsted
Beberapa asam Bronsted juga elektrofil. Misalnya, kation hidronium, H 3 O + , adalah elektrofil karena atom oksigen bermuatan positif. Karena sangat elektronegatif, ia akan berusaha mendapatkan elektron dengan menyumbangkan salah satu hidrogennya untuk mengubah dirinya menjadi molekul air.
Asam Bronsted lainnya seperti asam sulfat, H 2 SO 4 , juga merupakan elektrofil. Atom belerang sangat teroksidasi, dan akan berusaha untuk mendapatkan elektron dengan menyumbangkan dua hidrogennya.
Halogen
Halogen (F 2 , Cl 2 , Br 2 dan I 2 ) adalah elektrofil. Atom-atomnya tidak menunjukkan kekurangan elektronik; namun, ikatan mereka tidak stabil, karena kedua atom, XX, sangat menarik elektron ke mereka.
Oleh karena itu, halogen bereaksi sebagai oksidator, berperilaku sebagai elektrofil dan menerima pasangan elektron menjadi anion halida (F – , Cl – , Br – dan I – ).
Namun, halogen tidak hanya mendapatkan elektron dengan cara ini. Mereka juga dapat berikatan dengan atom yang kurang elektronegatif daripada dirinya sendiri untuk mendapatkan elektron bersih. Misalnya, inilah alasan mengapa mereka dapat ditambahkan ke ikatan rangkap alkena atau olefin.
Halogen mewakili jenis elektrofil yang berbeda dari dua yang diperkenalkan di awal. Namun, perilakunya pada akhirnya sama dengan semua elektrofil: menerima pasangan elektron.
Alkil dan hidrogen halida

Molekul CFC adalah alkil halida
Alkil dan hidrogen halida adalah elektrofil di mana atom yang terikat pada halogen memiliki kekurangan elektron kuat yang dilambangkan dengan simbol +. Ini karena halogen yang sangat elektronegatif menarik kerapatan elektron atom tetangga ke arahnya.
Untuk alkil halida, RX, R akan memiliki kekurangan elektronik sementara X akan memiliki kelebihan elektron, R δ + -X δ- . Jadi, jika spesies yang sangat negatif mendekati RX, ia akan menyerang R untuk mengikatnya dan menyebabkan X keluar sebagai anion.
Demikian juga, dalam hidrogen halida, HX, hidrogen memiliki kekurangan elektronik atau muatan parsial positif, H δ + -X δ- . Oleh karena itu, spesies negatif akan menyerahkan elektronnya ke hidrogen ini dan, sebagai elektrofil, akan menerimanya.
Senyawa karbonil
Asam, halogen, dan halida bukan satu-satunya molekul yang dapat diklasifikasikan sebagai elektrofil. Meskipun mungkin tidak tampak seperti itu, karbon dioksida, CO 2 , adalah elektrofil, karena atom karbon pusat sangat teroksidasi, O = C + = O.
Oleh karena itu, ketika CO 2 bereaksi, ia akan melakukannya dengan menerima pasangan elektron, baik menjadi gugus karboksilat, COOH, atau anion karbonat, CO 3 2- .
Selain CO 2 , senyawa karbonil seperti keton, aldehida dan ester juga merupakan contoh elektrofil, karena di dalamnya karbon memiliki muatan parsial positif dan cenderung menerima elektron dari spesies yang sangat negatif.
Karbokation
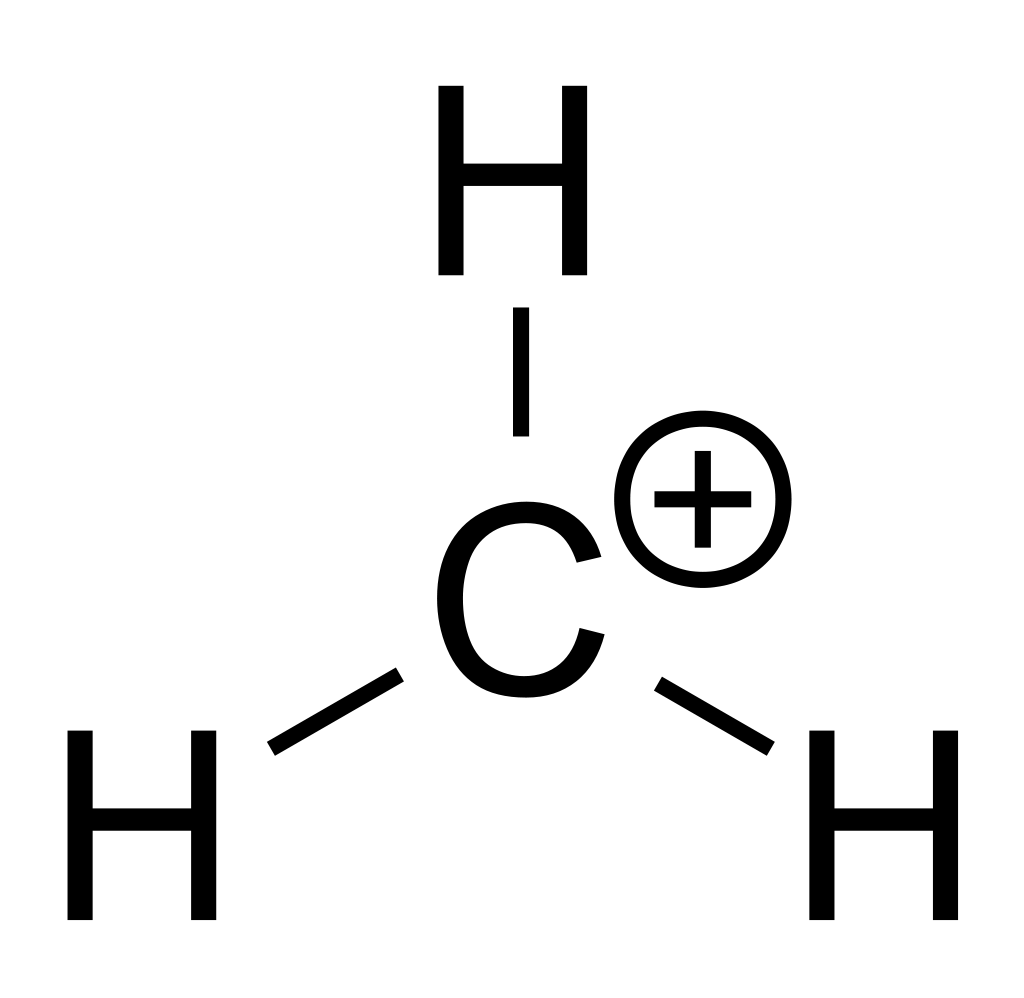
Atom karbon dari metana bermuatan positif
Karbokation adalah asam Lewis yang sangat kuat. Ada tersier (R 3 C + ), sekunder (R 2 HC + ) atau primer (RH 2 C + ). Karbon selalu membentuk empat ikatan, jadi kation khusus ini akan mencari cara untuk menerima elektron.
Elektrofilisitas
Tidak semua elektrofil sama-sama “lapar” akan elektron. Beberapa lebih reaktif daripada yang lain. Semakin besar kekurangan elektronik suatu elektrofil, semakin besar kepekaannya terhadap serangan nukleofilik dari spesies negatif. Artinya, ia akan menghadirkan elektrofilisitas yang lebih tinggi, yang merupakan ukuran relatif seberapa reaktif elektrofil yang dimaksud.
Misalnya, karbokation, nitronium, dan fluor memiliki elektrofilisitas yang tinggi; sedangkan karbon dioksida atau beberapa kation seperti natrium, memiliki elektrofilisitas yang rendah.
Referensi
- Menggigil & Atkins. (2008). Kimia Anorganik. (Edisi keempat). Bukit Mc Graw.
- Morrison, RT dan Boyd, R, N. (1987). Kimia Organik. Edisi ke-5. Editorial Addison-Wesley Interamericana.
- Carey F. (2008). Kimia Organik. (Edisi keenam). Bukit Mc Graw.
- Graham Solomons TW, Craig B. Fryhle. (2011). Kimia Organik. (edisi ke-10.). Wiley Plus.
- Wikipedia. (2020). Elektrofil. Dipulihkan dari: en.wikipedia.org
- James Ashenhurst. (2020). Nukleofil dan Elektrofil. Diperoleh dari: masterorganicchemistry.com
- Profesor Patricia Shapley. (2012). Nukleofil dan Elektrofil. Universitas Illinois. Dipulihkan dari: butane.chem.uiuc.edu
- Danielle Reid. (2020). Elektrofil: Pengertian & Contoh. Belajar. Diperoleh dari: study.com
- Tim Soderberg. (07 Oktober 2019). Elektrofil. LibreText Kimia. Dipulihkan dari: chem.libretexts.org