Keadaan gas adalah keadaan agregasi materi di mana partikel-partikel disatukan oleh interaksi yang lemah, yang mampu bergerak ke segala arah dari wadah yang berisi mereka. Dari semua wujud fisik materi, wujud gas adalah wujud yang mewujudkan kebebasan dan kekacauan terbesar.
Gas memberikan tekanan, membawa panas, dan terdiri dari semua jenis partikel kecil. Atmosfer kita dan udara yang kita hirup adalah manifestasi dari keadaan gas di Bumi.

Dalam emanasi asap, perilaku gas dapat diamati sebelum menyebar melalui atmosfer. Sumber: Pexels.
Contoh benda gas adalah gas rumah kaca , seperti uap air, karbon dioksida, metana, atau ozon. Karbon dioksida yang kita hembuskan dalam napas kita adalah contoh lain dari zat gas.
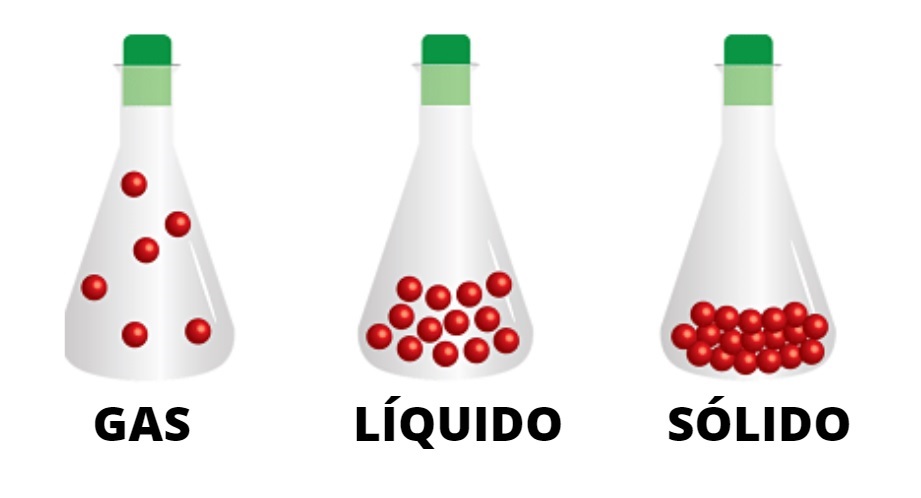
Partikel gas disatukan oleh interaksi lemah dan bergerak melalui wadah. Diamati bahwa partikel-partikel dari keadaan cair lebih bersatu, dan partikel-partikel padatan bersatu erat
Cairan dan padatan, misalnya, tidak akan berpindah ke posisi di luar batas materialnya sendiri, fakta yang tidak terjadi pada gas. Asap dari rokok, dari cerobong asap dan dari menara, menunjukkan dengan sendirinya bagaimana gas naik dan menyebar melalui lingkungan tanpa ada yang menghentikannya.
Ciri-ciri keadaan gas
Tidak memiliki volume atau bentuk
Keadaan gas ditandai dengan tidak memiliki bentuk atau volume yang ditentukan. Jika tidak ada batasan untuk menahannya, itu akan menyebar ke seluruh atmosfer. Bahkan seperti helium, ia akan keluar dari Bumi.
Gas hanya dapat mengambil bentuk yang ditentukan oleh wadah. Jika wadah berbentuk silinder, gas akan “berbentuk” seperti silinder.
Konduktor panas yang buruk
Keadaan ini juga ditandai dengan menjadi konduktor panas dan listrik yang buruk. Ini umumnya kurang padat dibandingkan dengan keadaan padat dan cair.
Karena sebagian besar gas tidak berwarna, seperti oksigen dan karbon dioksida, Anda dapat menentukan berapa banyak gas dalam wadah dengan mengukur tekanannya.
Reagen
Gas cenderung lebih reaktif, dengan pengecualian gas mulia, daripada cairan atau padatan, itulah sebabnya mereka berpotensi berbahaya, baik karena bahaya kebakaran, atau karena mereka dapat dengan mudah memasuki sistem pernapasan individu.
Partikel kecil
Partikel gas juga biasanya kecil, berupa atom atau molekul sederhana.
Misalnya, gas hidrogen, H 2 , adalah molekul yang sangat kecil yang terdiri dari dua atom hidrogen. Kita juga memiliki helium, He, yang atomnya bahkan lebih kecil.
Interaksi
Interaksi dalam keadaan gas dapat diabaikan. Dalam hal ini sangat berbeda dari keadaan cair dan padat, di mana partikel-partikelnya sangat kohesif dan berinteraksi kuat satu sama lain. Dalam molekul yang membentuk keadaan cair dan padat, hampir tidak ada ruang hampa molekul tertentu di antara keduanya.
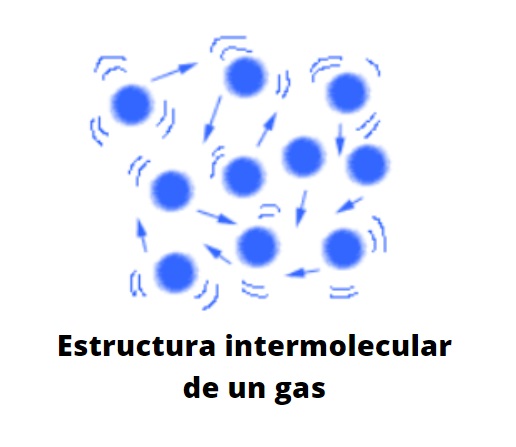
Partikel-partikel dalam keadaan gas sangat berjauhan satu sama lain, ada banyak ruang hampa di antara mereka. Ini bukan lagi ruang hampa dalam skala molekuler. Jarak yang memisahkan mereka begitu besar sehingga setiap partikel dalam gas bebas, acuh tak acuh terhadap sekitarnya, kecuali dalam lintasannya yang kacau itu bertabrakan dengan partikel lain atau dengan dinding wadah.
Jika diasumsikan tidak ada wadah, ruang hampa antara partikel gas dapat diisi oleh udara, yang mendorong dan menyeret gas ke arah arusnya. Itulah sebabnya udara, yang terdiri dari campuran gas, mampu mengubah bentuk dan menyebarkan zat gas di langit, selama mereka tidak lebih padat dari itu.
Hukum umum keadaan gas
Studi eksperimental tentang perilaku dan mekanika gas menghasilkan beberapa hukum (Boyle, Charles, Gay-Lussac) yang digabungkan untuk dapat memprediksi parameter sistem atau fenomena gas apa pun, yaitu, apa yang akan terjadi. suhu, volume dan tekanan.
Hukum umum ini memiliki ekspresi matematika berikut:
P = KT / V
Dimana K adalah konstanta, P tekanan, V volume, dan T suhu gas pada skala kelvin. Jadi, mengetahui dua variabel (misalnya, P dan V), yang ketiga dapat diselesaikan, yang akan menjadi tidak diketahui (T).
Hukum ini memungkinkan kita untuk mengetahui, misalnya, berapa suhu gas, yang tertutup dalam wadah volume V, untuk menunjukkan tekanan P.
Jika hukum ini kita tambahkan kontribusi Amadeus Avogadro, maka kita akan memiliki hukum gas ideal, yang juga melibatkan jumlah partikel, dan dengan mereka konsentrasi molar gas:
P = nRT / V
Dimana n sesuai dengan jumlah mol gas. Persamaan tersebut dapat ditulis ulang menjadi:
P = cRT
Dimana c adalah konsentrasi molar gas ( n / V). Jadi, dari hukum umum, diperoleh hukum ideal yang menggambarkan bagaimana tekanan, konsentrasi, suhu, dan volume gas ideal terkait.
Contoh wujud gas
Unsur gas
Tabel periodik itu sendiri menawarkan repertoar yang baik dari contoh unsur-unsur yang terjadi di Bumi sebagai gas. Di antara mereka kita memiliki:
-Hidrogen

-Helium
-Nitrogen
-Oksigen
-Fluor
-Klorin
-Neon
-Argon
-Kripton
-Xenon
Ini tidak berarti bahwa unsur-unsur lain tidak dapat menjadi gas. Misalnya, logam dapat berubah menjadi gas jika mengalami suhu yang lebih tinggi dari titik didihnya masing-masing . Jadi, mungkin ada gas dari partikel besi, merkuri, perak, emas, tembaga, zirkonium, iridium, osmium; dari logam apa pun.
Senyawa gas
Dalam daftar berikut kita memiliki beberapa contoh senyawa gas:
-Karbon monoksida, CO
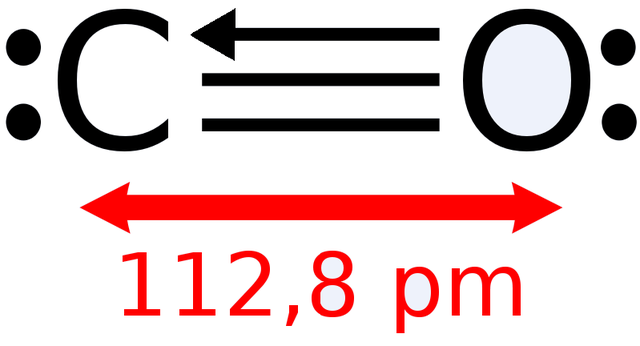
Struktur Lewis karbon monoksida
-Karbon dioksida, CO 2 (gas yang membuat embusan napas kita)
-Amonia, NH 3 (zat penting untuk proses industri tanpa akhir)
Trioksida -Belerang, SO 3
-Metana, CH 4 (gas domestik, yang digunakan untuk memasak)
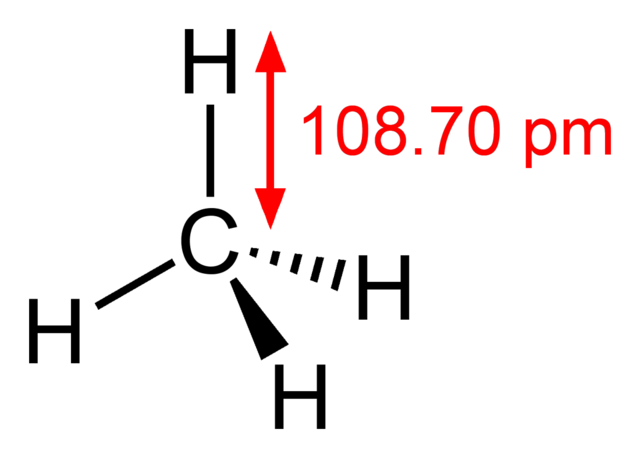
Struktur metana
-Ethane, CH 3 CH 3
-Nitrogen dioksida, NO 2 (gas brown)
-Fosgen, COCl 2 (zat yang sangat beracun)
-Udara (menjadi campuran nitrogen, oksigen, argon dan gas lainnya)
-Uap air, H 2 O (yang merupakan bagian dari awan, geyser, mesin penguap, dll).
-Asetilen, HC≡CH
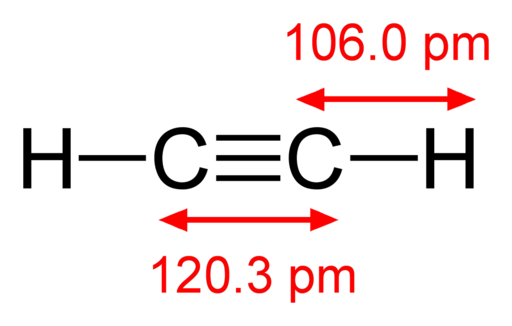
Rumus struktur asetilena
-Uap yodium, I 2 (gas ungu)
-Belerang hexafluoride, SF 6 (gas yang sangat padat dan berat)
-Hydrazine, N 2 H 4
-Hidrogen klorida, HCl (yang bila dilarutkan dalam air menghasilkan asam klorida)
Referensi
- Whitten, Davis, Peck & Stanley. (2008). Kimia . (edisi ke-8). CENGAGE Belajar.
- Wikipedia. (2020). Gas. Dipulihkan dari: en.wikipedia.org
- Edward A.Mason. (6 Februari 2020). Gas. Encyclopædia Britannica. Dipulihkan dari: britannica.com
- Helmenstine, Anne Marie, Ph.D. (11 Februari 2020). Pengertian Gas dan Contohnya dalam Kimia. Dipulihkan dari: thoughtco.com
- Maria Estela Rafino. (12 Februari 2020). Apa itu keadaan gas? Diperoleh dari: concept.de