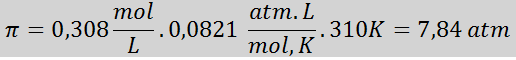Apa yang dimaksud dengan sifat koligatif?
Sifat koligatif , juga disebut sifat kolektif larutan, adalah kelompok empat sifat hanya bergantung pada jumlah partikel dalam larutan, tetapi sifat partikel-partikel ini.
Dengan kata lain, sifat-sifat ini muncul dari adanya partikel selain pelarut, yaitu partikel zat terlarut, tetapi tidak bergantung pada siapa zat terlarut itu. Setiap jenis partikel dapat menimbulkan sifat koligatif, tidak peduli apakah itu atom, ion atau molekul. Satu-satunya hal yang penting adalah konsentrasi Anda.
Sifat koligatif ada empat :
- Penurunan tekanan uap pelarut
- Kenaikan titik didih
- Penurunan krioskopik
- Tekanan osmotik
Semua dicirikan dengan proporsional terhadap konsentrasi zat terlarut dalam kasus larutan yang relatif encer (konsentrasi <0,2 M). Untuk larutan yang lebih terkonsentrasi, perilaku menjadi lebih kompleks dan sulit untuk dianalisis.
Mari kita lihat masing-masing dari empat sifat ini secara rinci:
1. Penurunan tekanan uap pelarut
Saat menyiapkan larutan zat terlarut yang tidak mudah menguap, tekanan uap larutan yang dihasilkan selalu lebih kecil dari tekanan uap pelarut murni. Dengan kata lain, melarutkan zat terlarut yang tidak mudah menguap dalam pelarut menyebabkan penurunan tekanan uap pelarut itu, dibandingkan dengan pelarut murni.
Rumus penurunan tekanan uap
Seperti semua sifat koligatif, penurunan tekanan uap (DP) sebanding dengan konsentrasi zat terlarut. Dengan menggabungkan hukum Raoult dengan persamaan fraksi mol, dapat ditunjukkan bahwa DP diberikan oleh:
![]()
di mana P ° pelarut mewakili tekanan uap pelarut murni pada suhu tertentu, larutan P sesuai dengan tekanan uap larutan dan zat terlarut X mewakili konsentrasi zat terlarut yang dinyatakan sebagai fraksi mol.
Mengapa tekanan uap berkurang dengan zat terlarut?
Kekuatan pendorong di balik sebagian besar proses alami, seperti penguapan pelarut, adalah peningkatan entropi atau tingkat ketidakteraturan. Ketika cairan menguap, ia berubah dari keadaan yang sangat teratur (dalam cairan) menjadi sangat tidak teratur (dalam gas), karena dalam fase gas ada lebih banyak kebebasan bergerak.
Namun, dalam larutan, kehadiran zat terlarut menambah gangguan pada fase cair sementara itu tidak mempengaruhi fase gas (karena zat terlarut tidak menguap).
Untuk alasan ini, perbedaan tingkat ketidakteraturan antara larutan dan fase gas lebih kecil daripada antara pelarut murni dan fase gas, sehingga pelarut memiliki kecenderungan yang lebih kecil untuk menguap dalam kasus kedua.
Contoh
Soal: mengetahui bahwa tekanan uap air pada suhu tertentu adalah 30,55 mmHg, tentukan tekanan uap larutan yang dibuat dengan melarutkan 7,20 gram glukosa (massa molar atau MM = 180g / mol) dalam 360 g air (MM = 18,0 g/mol) pada suhu yang sama.
Penyelesaian: dalam hal ini, fraksi mol zat terlarut harus dihitung terlebih dahulu. Kita sudah memiliki semua data yang diperlukan untuk ini:
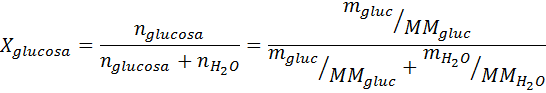
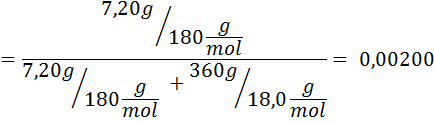
![]()
Kemudian persamaan penurunan tekanan uap diterapkan.
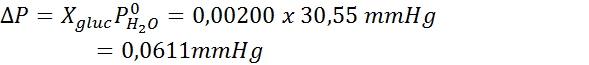
Sekarang kita tentukan tekanan uap pelarut yang baru:
![]()
![]()
![]()
2. Kenaikan titik didih
Kenaikan didih mengacu pada peningkatan titik didih larutan dibandingkan dengan titik didih pelarut murni. Untuk memahami mengapa ini terjadi, mari kita ingat bahwa titik didih didefinisikan sebagai suhu di mana tekanan uap cairan menjadi sama dengan tekanan atmosfer.
Karena larutan memiliki tekanan uap yang lebih rendah daripada pelarut murni (seperti yang baru saja kita lihat di bagian sebelumnya), perlu untuk memanaskannya lebih banyak untuk dapat mencapai tekanan atmosfer dan dengan demikian mencapai titik didihnya. Karena alasan ini, titik didih larutan (dengan zat terlarut yang tidak mudah menguap) selalu lebih tinggi daripada titik didih pelarut murni.
Rumus ketinggian didih
Kenaikan titik didih (DT b ) sebanding dengan konsentrasi zat terlarut yang dinyatakan dalam molalitas, seperti yang ditunjukkan oleh persamaan berikut:
![]()
Dimana T b adalah titik didih larutan, T b ° adalah titik didih pelarut murni, K b adalah konstanta didih pelarut dan m adalah molalitas zat terlarut.
Contoh
Soal: Mengetahui bahwa konstanta didih air adalah 0,52 ° C. Kg / mol, tentukan titik didih larutan glukosa yang disiapkan pada contoh sebelumnya.
Larutan: untuk menentukan elevasi ebulloscopic kita hanya membutuhkan molalitas.
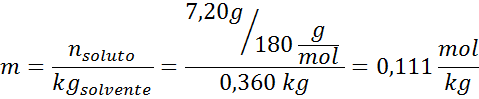
Sekarang kita terapkan rumus untuk DT b :
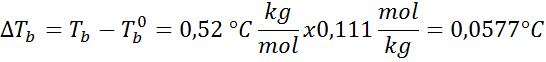
![]()
3. Penurunan krioskopik
Penurunan krioskopi adalah penurunan titik beku larutan dibandingkan dengan titik beku pelarut murni. Alasan mengapa ini terjadi mirip dengan kenaikan didih dan berasal dari penurunan tekanan uap.
Sifat ini banyak digunakan di negara-negara beriklim dingin di mana salju turun di musim dingin. Di negara-negara ini, sangat umum melihat truk menyebarkan garam seperti NaCl atau CaCl 2 di jalan atau di bangku umum, setelah itu salju mencair. Alasan mencairnya garam adalah karena menurunkan titik beku air.
Rumus keturunan krioskopik
Persamaan untuk penurunan cryoscopic sangat mirip dengan kenaikan ebullioscopic. Ini juga sebanding dengan konsentrasi molal dan tergantung, dalam hal ini, pada konstanta krioskopi pelarut.
![]()
di mana T f adalah titik beku larutan, T f ° adalah titik beku pelarut murni, K f adalah konstanta krioskopi pelarut dan m adalah molalitas zat terlarut.
Contoh
Soal: Mengetahui bahwa konstanta krioskopi air adalah 1,86 ° C. Kg / mol, tentukan titik beku larutan glukosa yang disiapkan pada contoh sebelumnya.
Penyelesaian: Molalitas larutan telah ditentukan, jadi kita dapat langsung melanjutkan ke penentuan DT f menggunakan rumus di atas:
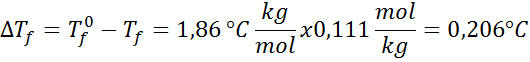
![]()
4. Tekanan osmotik
Osmosis adalah proses yang sangat penting pada tingkat kimia dan biologi. Ini terdiri dari aliran molekul pelarut (misalnya, air) dari larutan encer ke larutan lain yang lebih pekat ketika ini dipisahkan melalui membran semi-permeabel (yang hanya memungkinkan pelarut lewat, tetapi bukan zat terlarut).
Kecenderungan untuk “menyerap” pelarut melalui membran semi-permeabel adalah sifat yang hanya bergantung pada konsentrasi total partikel zat terlarut yang ada dalam larutan, tidak peduli apa zat terlarut itu. Untuk alasan ini, kecenderungan ini adalah sifat koligatif, dan diukur melalui tekanan osmotik.
Tekanan osmotik (π) adalah tekanan yang harus diberikan pada larutan untuk menghentikan osmosis. Semakin tinggi tekanan osmotik, semakin besar kecenderungan larutan untuk menyerap pelarut (atau, lebih tepatnya, semakin besar kecenderungan pelarut untuk berdifusi menuju larutan tersebut).
Mengapa terjadi osmosis?
Penjelasan di balik proses osmosis sangat sederhana. Semua zat cenderung berdifusi dari tempat paling pekat ke tempat paling encer. Ini diperintahkan untuk mengikuti gradien konsentrasi Anda.
Ketika suatu larutan lebih terkonsentrasi dalam zat terlarut, pada saat yang sama lebih encer dalam pelarut dan sebaliknya. Untuk alasan ini, pelarut memiliki kecenderungan alami untuk beralih dari larutan yang paling encer (di mana pelarut paling pekat) ke larutan yang paling pekat (di tempat yang paling encer).
Rumus tekanan osmotik
Tekanan osmotik dapat dihitung dengan rumus yang sangat mirip dengan persamaan gas ideal:
![]()
Dalam persamaan ini, adalah tekanan osmotik, M adalah konsentrasi molar zat terlarut, R adalah konstanta gas ideal universal (0,0821 atm.L / mol.K) dan T adalah suhu absolut dalam K.
Tekanan osmotik dan tonisitas
Tekanan osmotik sangat penting untuk fungsi tubuh manusia. Sebenarnya, larutan garam yang disuntikkan secara intravena diklasifikasikan menurut apakah tekanan osmotiknya lebih besar, sama dengan atau kurang dari plasma darah, yang disebut tonisitas.
- Suatu larutan yang kurang pekat dari plasma memiliki tekanan osmotik yang lebih rendah dan disebut larutan hipotonik .
- Jika memiliki konsentrasi total zat terlarut yang sama, itu disebut larutan isotonik .
- Jika memiliki tekanan osmotik (atau konsentrasi) yang lebih tinggi, itu disebut larutan hipertonik .
Contoh
Soal: Hitung tekanan osmotik pada 310 K larutan garam 0,9% (m / V), yang isotonik dengan plasma darah.
Jawab: kita sudah memiliki suhu, jadi yang tersisa hanyalah menentukan konsentrasi molar partikel garam (NaCl) dalam larutan. Untuk ini, fakta bahwa natrium klorida, ketika dilarutkan dalam air, terpisah menjadi dua ion, harus diperhitungkan, sehingga konsentrasi total partikel akan menjadi dua kali konsentrasi total garam.
Setiap 100 mL larutan mengandung 0,9 g NaCl, jadi:
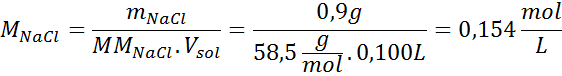
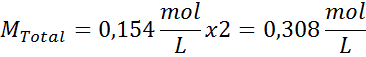
Ini adalah konsentrasi total partikel zat terlarut dalam larutan, jadi sekarang kita dapat menghitung tekanan osmotik: