
Apa itu kalsium sulfat?
Kalsium sulfat adalah garam kalsium terner, logam alkali tanah (Mr Becambara), sulfur dan oksigen. Rumus kimianya adalah CaSO 4 , yang berarti bahwa untuk setiap kation Ca 2+ terdapat anion SO 4 2- yang berinteraksi dengannya. Ini adalah senyawa dengan distribusi yang luas di alam.
Bentuknya yang paling melimpah adalah CaSO 4 · 2H 2 O (gipsum) dan bentuk anhidrat CaSO 4 (anhidrit). Ada juga bentuk ketiga: plester Paris, diproduksi dengan memanaskan plester (hemidrat, CaSO 4 · 1 / 2H 2 O).
Kalsium sulfat adalah senyawa yang sangat berguna bagi manusia, karena digunakan dalam berbagai fungsi yang mencakup konstruksi jalan, mempercantik rumah dan bahkan perbaikan tulang.
Struktur kimia kalsium sulfat
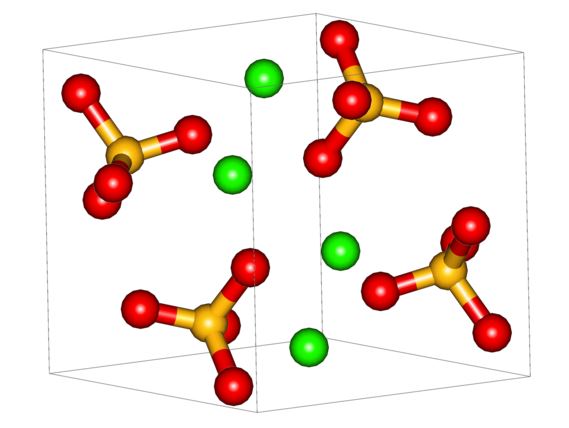
Gambar atas menunjukkan sel satuan ortorombik untuk CaSO 4 . Di sini diasumsikan bahwa interaksinya murni elektrostatik; yaitu, kation Ca 2+ menarik anion tetrahedral SO 4 2– .
Namun, Ca 2+ sangat rentan untuk berkoordinasi, membentuk struktur polihedral di sekitarnya. Untuk apa ini? Ketersediaan elektronik kalsium untuk menerima elektron dari spesies dasar atau negatif (seperti atom O dari SO 4 2– ).
Mempertimbangkan poin sebelumnya, sekarang ion Ca 2+ menerima ikatan datif (disumbangkan oleh O) dan sel satuan ditransformasikan, seperti yang ditunjukkan pada gambar di bawah ini:
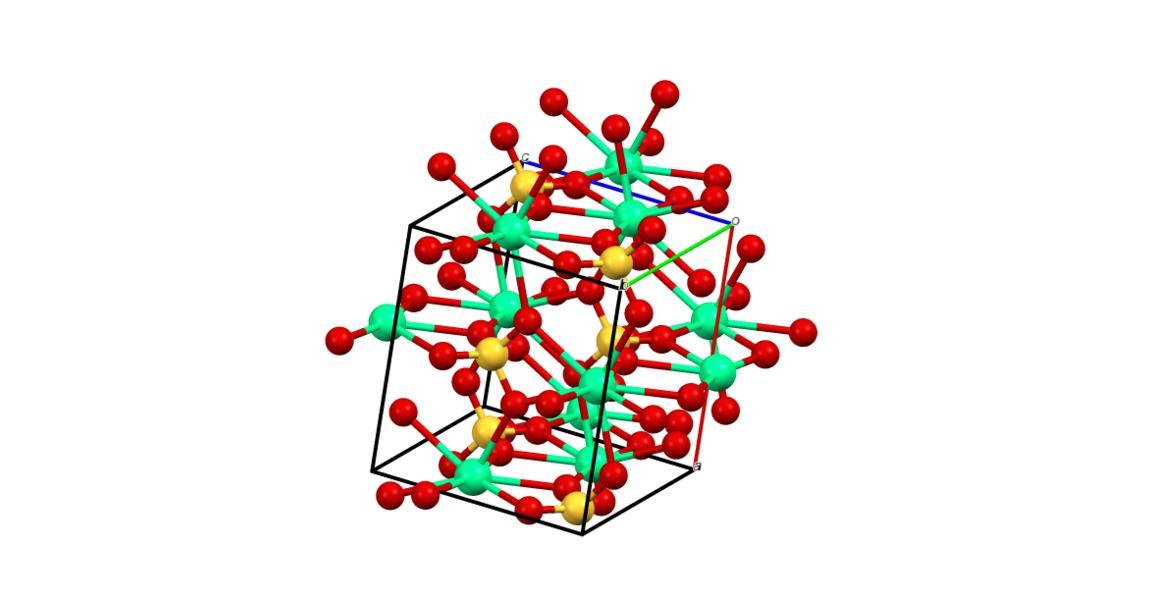
Akibatnya, polihedron CaO 8 terbentuk (bola Ca 2+ hijau dikelilingi oleh delapan bola O merah dari tetrahedra SO 4 terdekat). Kalsium polihedra dan sulfat tetrahedra; ini adalah struktur kristal CaSO 4 anhidrat.
Selain itu, ketika kristal terhidrasi – membentuk garam dihidrat atau hemidrate (CaSO 4 · 1/2 H 2 O) – strukturnya mengembang untuk menggabungkan molekul air.
Molekul-molekul ini dapat berinterkalasi dan berkoordinasi dengan kalsium; yaitu, mereka menggantikan satu atau dua kelompok sulfat.
Di sisi lain, tidak semua air menjadi bagian dari polihedron CaO 8 . Beberapa, di sisi lain, membentuk ikatan hidrogen dengan sulfat. Ini berfungsi sebagai persimpangan untuk dua bagian zigzag, produk dari susunan ion dalam kristal.
Sifat kalsium sulfat

Penampilan kalsium sulfat
Rumus molekul
CaSO4 · nH2O.
Berat molekul anhidrat
136,134 g / mol.
Bau
Ini tidak berbau.
Penampilan
Dalam kasus anhidrit, terlihat seperti bubuk putih atau kristal ortorombik atau monoklinik padat. Kristal memiliki warna yang bervariasi: mereka bisa putih atau dengan warna kebiruan, keabu-abuan, atau kemerahan; bisa juga merah bata.
Kepadatan
2,96 g / cm3 (bentuk anhidrat). 2,32 g / cm3 (bentuk dihidrat).
Titik lebur
1450 ° C (2840 ° F). Ciri-ciri interaksi elektrostatik yang kuat antara ion divalen Ca 2+ dan SO 4 2- .
Kelarutan
0,2-0,3% dalam air pada 25 ° C. Ini kurang larut dalam air dan tidak larut dalam etanol.
Stabilitas
Stabil pada suhu kamar.
Kegunaan kalsium sulfat
Dalam konstruksi dan seni
Ini digunakan dalam elaborasi plesteran untuk menghiasi dinding rumah dan konstruksi lain yang berkontribusi pada keindahannya. Selain itu, relief dibuat dengan menggunakan cetakan di langit-langit dan bingkai jendela. Plester juga ada di langit-langit.
Kalsium sulfat digunakan untuk membantu memecahkan masalah yang terjadi pada hidrasi beton, sehingga bekerja sama dalam pembangunan jalan, jalan, dll.
Dengan patung-patung plester dibuat, terutama tokoh agama, dan di kuburan mereka digunakan di batu nisan.
Terapi
dokter hewan
Secara eksperimental, potongan kalsium sulfat steril telah digunakan dalam kedokteran hewan untuk memperbaiki cacat tulang atau rongga, seperti yang ditinggalkan oleh luka atau tumor.
Plester Paris dapat digunakan untuk memperbaiki cacat tulang karena kemampuannya yang unik untuk merangsang osteogenesis. Studi sinar-X dan medronat teknesium (Tc99m) mendukung penggunaan plester Paris sebagai aloplastik dan kapasitas osteogeniknya saat ditanamkan di sinus frontal.
Regenerasi tulang telah ditunjukkan pada enam anjing dalam periode 4 hingga 6 bulan. Kalsium sulfat mulai digunakan di bidang ini pada tahun 1957, dalam bentuk plester tablet paris, karena mampu mengisi cacat pada tulang anjing.
Substitusi tulang kalsium sulfat sebanding dengan yang diamati pada tulang autogenik.
Ruhaimi (2001) menerapkan kalsium sulfat ke tulang rahang kelinci yang baru saja dihancurkan, mengamati peningkatan osteogenesis dan kalsifikasi tulang.
Obat
Kalsium sulfat digunakan dalam pengobatan untuk melumpuhkan sendi yang terkilir dan tulang yang retak, serta digunakan sebagai eksipien dalam pembuatan tablet.
ilmu gigi
Dalam kedokteran gigi digunakan sebagai dasar untuk membuat protesa gigi, dalam restorasi dan pencetakan gigi.
Dalam pengolahan makanan
Ini digunakan sebagai koagulan dalam produksi tahu, makanan yang dibuat dengan kedelai dan banyak dikonsumsi di negara-negara timur sebagai pengganti daging. Selain itu, telah digunakan sebagai pengencang makanan dan dalam pengobatan tepung.
Sebagai pupuk dan kondisioner untuk tanah tanaman
Gypsum (CaSO 4 · 2H 2 O) digunakan sebagai pupuk di Eropa sejak abad ke-18, memiliki keunggulan dibandingkan penggunaan kapur sebagai sumber kalsium dengan mobilitas yang lebih besar.
Kalsium harus tersedia untuk akar tanaman untuk pasokan yang memadai. Sehingga penambahan kalsium memperbaiki tanaman hortikultura dan kacang tanah (groundnut).
Busuk akar kacang tanah yang disebabkan oleh patogen biologis, serta busuk ujung buah semangka dan tomat, sebagian dikendalikan dengan kegunaan gipsum pertanian.
Gypsum membantu mengurangi dispersi tanah liat, yang menyebabkan pembentukan kerak di tanah. Dengan mengurangi kerak yang terbentuk di tanah, plester memfasilitasi keluarnya bibit. Demikian juga, meningkatkan masuknya udara dan air ke tanah.
Gypsum membantu memperbaiki tanah dengan mengurangi keasaman dan toksisitas aluminium, sehingga membuat tanaman cocok untuk tanah natrium.
Dalam produksi senyawa lain
Kalsium sulfat bereaksi dengan amonium bikarbonat membentuk amonium sulfat. Ini juga telah digunakan dalam proses produksi asam sulfat.
Kalsium sulfat anhidrat dicampur dengan serpih atau lean dan, saat campuran dipanaskan, belerang trioksida dilepaskan dalam bentuk gas. Belerang oksida adalah prekursor asam sulfat.