Reaksi Netralisasi adalah salah satu yang terjadi antara asam dan spesies basa dengan cara kuantitatif. Secara umum, dalam jenis reaksi ini dalam media berair, air dan garam (spesi ion yang terdiri dari kation selain H + dan anion selain OH – atau O 2- ) diproduksi sesuai dengan persamaan berikut: asam + basa → garam + air.
Dalam reaksi netralisasi, elektrolit memiliki dampak, yaitu zat yang, ketika dilarutkan dalam air, menghasilkan larutan yang memungkinkan konduktivitas listrik. Asam, basa, dan garam dianggap elektrolit .

Dengan cara ini, elektrolit kuat adalah spesies yang sepenuhnya terdisosiasi menjadi ion penyusunnya ketika berada dalam larutan, sedangkan elektrolit lemah hanya terionisasi sebagian (mereka memiliki kapasitas yang lebih kecil untuk menghantarkan arus listrik; yaitu, mereka bukan konduktor yang baik seperti kuat elektrolit).
Ciri-ciri Reaksi Netralisasi
Pertama-tama, harus ditekankan bahwa jika reaksi netralisasi dimulai dengan jumlah asam dan basa yang sama (dalam mol), ketika reaksi tersebut berakhir, hanya satu garam yang diperoleh; yaitu, tidak ada jumlah sisa asam atau basa.
Juga, sifat yang sangat penting dari reaksi asam-basa adalah pH, yang menunjukkan seberapa asam atau basa suatu larutan. Ini ditentukan oleh jumlah ion H + yang ditemukan dalam larutan yang diukur.
Di sisi lain, ada beberapa konsep keasaman dan kebasaan tergantung pada parameter yang dipertimbangkan. Salah satu konsep yang menonjol adalah Brønsted dan Lowry, yang menganggap asam sebagai spesi yang mampu menyumbangkan proton (H + ) dan basa sebagai spesi yang mampu menerimanya.
Titrasi asam basa
Untuk mempelajari dengan benar dan kuantitatif reaksi netralisasi antara asam dan basa, teknik yang disebut titrasi asam-basa (atau titrasi) diterapkan.
Titrasi asam-basa terdiri dari penentuan konsentrasi asam atau basa yang diperlukan untuk menetralkan sejumlah basa atau asam yang konsentrasinya diketahui.
Dalam prakteknya, larutan standar (yang konsentrasinya diketahui dengan tepat) harus ditambahkan secara bertahap ke dalam larutan yang konsentrasinya tidak diketahui sampai titik ekivalen tercapai, di mana salah satu spesies telah menetralkan sepenuhnya yang lain.
Titik ekivalen dideteksi oleh perubahan warna indikator yang telah ditambahkan ke larutan yang konsentrasinya tidak diketahui ketika reaksi kimia antara kedua larutan telah selesai.
Misalnya, dalam kasus netralisasi asam fosfat (H 3 PO 4 ) akan ada titik ekivalen untuk setiap proton yang dilepaskan dari asam; yaitu, akan ada tiga titik ekivalen dan tiga perubahan warna akan diamati.
Produk dari reaksi netralisasi
Dalam reaksi asam kuat dengan basa kuat, netralisasi spesi yang lengkap terjadi, seperti dalam reaksi antara asam klorida dan barium hidroksida:
2HCl (aq) + Ba (OH) 2 (aq) → BaCl 2 (aq) + 2H 2 O (l)
Jadi tidak ada kelebihan ion H + atau OH – yang dihasilkan , yang berarti bahwa pH larutan elektrolit kuat yang telah dinetralkan secara intrinsik berkaitan dengan keasaman reaktannya.
Sebaliknya, dalam kasus netralisasi antara elektrolit lemah dan kuat (asam kuat + basa lemah atau asam lemah + basa kuat), disosiasi parsial elektrolit lemah diperoleh dan konstanta disosiasi asam (K a ) muncul atau basa lemah (K b ), untuk menentukan sifat asam atau basa dari reaksi bersih dengan menghitung pH.
Misalnya, kita memiliki reaksi antara asam hidrosianat dan natrium hidroksida:
HCN (aq) + NaOH (aq) → NaCN (aq) + H 2 O (l)
Dalam reaksi ini, elektrolit lemah tidak terionisasi secara nyata dalam larutan, sehingga persamaan ion bersih direpresentasikan sebagai berikut:
HCN (aq) + OH – (aq) → CN – (aq) + H 2 O (l)
Ini diperoleh setelah menuliskan reaksi dengan elektrolit kuat dalam bentuk terdisosiasinya (Na + (aq) + OH – (aq) di sisi reaktan, dan Na + (aq) + CN – (aq) di sisi produk ), di mana hanya ion natrium yang menjadi pengamat.
Akhirnya, dalam kasus reaksi antara asam lemah dan basa lemah, netralisasi tersebut tidak terjadi. Ini karena kedua elektrolit terdisosiasi sebagian, tanpa menghasilkan air dan garam yang diharapkan.
Contoh Reaksi Netralisasi
Asam kuat + basa kuat
Contohnya adalah reaksi yang diberikan antara asam sulfat dan kalium hidroksida dalam media berair, menurut persamaan berikut:
H 2 SO 4 (aq) + 2KOH (aq) → K 2 SO 4 (aq) + 2H 2 O (l)
Dapat dilihat bahwa baik asam maupun hidroksida adalah elektrolit kuat; oleh karena itu, mereka benar-benar terionisasi dalam larutan. PH larutan ini akan tergantung pada elektrolit kuat yang dalam proporsi tertinggi.
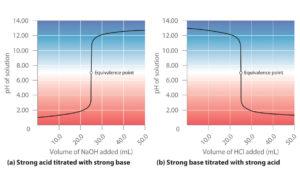
Asam kuat + basa lemah
Netralisasi asam nitrat dengan amonia menghasilkan senyawa amonium nitrat, seperti yang ditunjukkan di bawah ini:
HNO 3 (aq) + NH 3 (aq) → NH 4 NO 3 (aq)
Dalam hal ini, air yang dihasilkan dengan garam tidak diamati, karena harus direpresentasikan sebagai:
HNO 3 (aq) + NH 4 + (aq) + OH – (aq) → NH 4 NO 3 (aq) + H 2 O (l)
Jadi air dapat dilihat sebagai produk reaksi. Dalam hal ini, larutan akan memiliki pH yang pada dasarnya asam.
Asam lemah + basa kuat
Reaksi yang terjadi antara asam asetat dan natrium hidroksida ditunjukkan di bawah ini:
CH 3 COOH (aq) + NaOH (aq) → CH 3 COONa (aq) + H 2 O (l)
Karena asam asetat adalah elektrolit lemah, ia terdisosiasi sebagian, menghasilkan natrium asetat dan air, yang larutannya akan memiliki pH basa.
Asam lemah + basa lemah
Terakhir, dan seperti yang dinyatakan sebelumnya, basa lemah tidak dapat menetralkan asam lemah; tidak juga sebaliknya. Kedua spesies terhidrolisis dalam larutan berair dan pH larutan akan tergantung pada “kekuatan” asam dan basa.
Referensi
- Wikipedia. (sf). Netralisasi (Kimia). Dipulihkan dari en.wikipedia.org
- Chang, R. (2007). Kimia, edisi Kesembilan (McGraw-Hill).
- Raymond, KW (2009). Kimia Organik dan Biologi Umum. Dipulihkan dari books.google.co.ve
- Joesten, MD, Hogg, JL dan Castellion, ME (2006). Dunia Kimia: Esensial. Dipulihkan dari books.google.co.ve
- Clugston, M. dan Flemming, R. (2000). Kimia Lanjutan. Dipulihkan dari books.google.co.ve
- Reger, DL, Goode, SR dan Bola, DW (2009). Kimia: Prinsip dan Praktek. Dipulihkan dari books.google.co.ve