Timbal iodida adalah senyawa anorganik yang dibentuk oleh unsur timbal (Pb) dalam keadaan oksidasi +2 dan yodium (I) dengan valensi -1. Rumus kimianya adalah PbI 2 . Ini adalah senyawa beracun. Karena mengandung timbal, maka berbahaya bagi manusia, hewan dan ekosistem alam. Selain itu, iodida juga dapat menyebabkan beberapa penyakit.
Senyawa PbI 4 , yaitu dengan timbal dalam keadaan oksidasi +4, tampaknya tidak ada, mungkin karena kapasitas reduksi ion iodida (I – ). PbI 2 adalah padatan kuning keemasan dengan sedikit larut dalam air.

Timbal iodida padat (PbI 2 ). W. Oelen / CC BY-SA (https://creativecommons.org/licenses/by-sa/3.0). Sumber: Wikimedia Commons.
Timbal iodida dapat diperoleh dengan menggunakan reaksi pertukaran ion antara garam iodida dan garam timbal yang keduanya larut dalam air.
Ini memiliki sifat semikonduktor, sehingga sebagian besar kegunaan saat ini dalam perangkat fotovoltaik, detektor radiasi dan sensor tertentu.
Salah satu kegunaan yang paling banyak dipelajari dari senyawa Timbal iodida ini adalah sel surya perovskit, yang telah terbukti sangat efisien dan murah.
Struktur Timbal iodida
Dalam timbal iodida, ikatan antara atom-atomnya hanya sebagian ion. Atom membentuk lapisan dengan struktur heksagonal dan ini dihubungkan bersama oleh gaya Van der Waals yang lemah.
Gaya-gaya ini bukan ion atau kovalen, mereka adalah interaksi lemah antara kulit elektron atom.
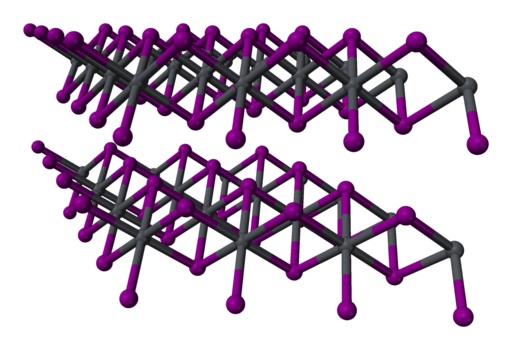
Struktur dua lapis tiga dimensi dari kristal PbI 2 . Abu-abu = timah; ungu = yodium. Benjah-bmm27 / Domain publik. Sumber: Wikimedia Commons.
Tata nama Timbal iodida
- Timbal iodida
- Timbal (II) iodida
- Timbal diiodida
- Plumb iodida
Sifat Timbal iodida
Keadaan fisik
Padatan kristal kuning cerah. Kristal heksagonal.

Kristal heksagonal timbal iodida. Alessandro e Damiano / CC BY (https://creativecommons.org/licenses/by/4.0). Sumber: Wikimedia Commons.
Berat molekul
461 g / mol
Titik lebur
410 C
Titik didih
954 ° C, mendidih dengan dekomposisi.
Kepadatan
6.16 g / cm 3
Kelarutan
Sedikit larut dalam air: 0,076 g / 100 mL pada 25 ° C. Larut dalam air panas. Tidak larut dalam alkohol dan asam klorida dingin (HCl).
Sifat kimia Timbal iodida
Sifat oksidasi dan pereduksinya lemah. Namun, itu dapat menunjukkan reaksi redoks.
Meskipun sangat buruk larut dalam air, larut dalam larutan pekat iodida alkali seperti kalium iodida (KI). Ini larut dalam larutan natrium asetat pekat (CH 3 COONa). Ini larut bebas dalam larutan natrium tiosulfat (Na 2 S 2 O 3 ).
Beberapa penulis menunjukkan bahwa ion PbI + dapat dihasilkan dalam air dan jika ada kelebihan ion iodida (I – ), spesies yang lebih kompleks seperti PbI 3 – dan PbI 4 2- , antara lain, dapat terbentuk.
Ini tidak mudah terbakar.
Sifat fisik lainnya
Ini berperilaku seperti semikonduktor, yaitu, mungkin atau mungkin tidak menghantarkan listrik tergantung pada kondisi yang dikenakannya.
Ini adalah semikonduktor celah langsung, yaitu, agar salah satu elektronnya berpindah dari pita valensi ke pita konduksi, ia hanya perlu memiliki jumlah energi yang sama dengan bandwidth terlarang.
Karena nomor atom yang tinggi dari unsur-unsurnya (Pb = 82, I = 53) ia memiliki kapasitas fotolistrik yang tinggi. Pita celah 2,5 eV memungkinkan kinerja fotovoltaik yang sangat efisien pada suhu hingga 250 ° C.
Mendapatkan
Ini dapat dibuat dengan mereaksikan senyawa timbal yang larut dalam air dengan asam hidroiodik (HI) atau dengan iodida logam yang larut. Misalnya, larutan berair timbal asetat dicampur dengan kalium iodida:
Pb (CH 3 COO) 2 + 2 KI → PbI 2 + 2 K (CH 3 COO)
Jenis reaksi ini dikenal sebagai “pertukaran ion” karena kation dan anion dipertukarkan antara garam.
Dalam contoh yang disebutkan, kalium asetat sangat larut dalam air dan tetap larut, sedangkan kalium iodida, karena kurang larut, mengendap dan dapat disaring. Pemurnian dilakukan dengan cara rekristalisasi senyawa dari air.
Pengendapan PbI 2 dapat diamati pada gambar berikut yang menunjukkan tabung reaksi di mana timbal (II) nitrat (Pb (NO 3 ) 2 ) dan kalium iodida (KI) dicampur dalam larutan berair. Efek ini disebut “mandi emas.”

Pancuran emas PbI 2 . Stefano sct / CC BY-SA (https://creativecommons.org/licenses/by-sa/4.0). Sumber: Wikimedia Commons.
Kegunaan Timbal iodida
Sebagai semikonduktor
Ini digunakan sebagai detektor untuk foton berenergi tinggi seperti sinar-X dan sinar gamma. Hal ini dapat digunakan dalam perangkat fotovoltaik, fotosel, lampu LED, detektor optik dan sensor untuk klasifikasi dan diagnosis biologis.
Jika dimasukkan ke dalam struktur nano, dapat digunakan dalam fotokatalisis dan sel surya. Selain itu, banyak PBI 2 nanopartikel memiliki sifat luminescent.

Timbal iodida digunakan dalam detektor di perangkat sinar-X medis Penulis: lkcjjang40090. Sumber: Pixabay.
Sel surya
PbI 2 adalah perantara dalam sintesis perovskit untuk sel surya. Jenis sel fotovoltaik ini mengandung timbal metilamonium iodida (CH 3 NH 3 PbI 3 ) pada basis TiO 2 .
Perangkat tersebut memiliki efisiensi tinggi dan biaya rendah, itulah sebabnya mereka telah menjadi subyek banyak penelitian dan penelitian.

Sel surya di atap sebuah rumah di pedesaan. Sel surya yang menggunakan PbI 2 sangat efisien dan murah, sehingga dapat digunakan di rumah-rumah di masa depan. Pengarang: Manfred Antranias Zimmer. Sumber: Pixabay.
Namun, karena CH 3 NH 3 PbI 3 dapat terurai dengan air hujan, telah dipelajari bagaimana polusi sel-sel ini baik saat digunakan maupun saat dibuang.
Ketika CH 3 NH 3 PbI 3 bersentuhan dengan air, ia terurai menjadi metilamin (CH 3 NH 2 ), asam hidroiodik dan PbI 2 . Yang terakhir, meskipun kurang larut dalam air, dapat melepaskan sejumlah ion Pb2 + beracun dari waktu ke waktu .
Studi ini tidak konklusif, karena tempat terjadinya pelepasan timbal harus diperhitungkan untuk menentukan apakah jumlahnya mungkin berbahaya dalam jangka pendek. Di sisi lain, pelepasan berkelanjutan dapat terakumulasi secara biologis dan sangat berbahaya.
Kegunaan lain
- Itu ditaburkan sebagai aerosol di awan untuk menghasilkan hujan.
- Dalam filter untuk astronomi inframerah jauh.
- Dalam fotografi, cetakan, film untuk merekam gambar optik, emulsi fotografi.
- Di kampas rem. Dalam pelumas gemuk.
- Lampu busur uap merkuri. Pada kertas elektrosensitif.
- Bahan termoelektrik, baterai termal dengan yodium.
Resiko
Untuk keamanan
Ini harus disimpan jauh dari oksidan seperti perklorat, peroksida, permanganat, klorat dan nitrat. Kontak dengan logam kimia aktif seperti kalium, natrium, magnesium dan seng juga harus dihindari. Dalam semua kasus ini reaksi kekerasan dapat terjadi.
Jika mengalami pemanasan yang kuat, timbal beracun dan gas yodium dihasilkan.
Untuk kesehatan
Itu sangat merugikan manusia. Telah dipastikan bersifat karsinogenik bagi hewan, oleh karena itu cukup beralasan bahwa ini juga bersifat karsinogenik bagi manusia.
Ini dapat menyebabkan sakit kepala, lekas marah, mengurangi memori, dan mengganggu tidur. Timbal yang terkandung dalam senyawa ini dapat menyebabkan kerusakan permanen pada ginjal , otak, saraf, sel darah dan risiko tekanan darah tinggi.
Ini harus ditangani sebagai teratogen (senyawa yang dapat menyebabkan cacat bawaan). Juga dapat menyebabkan iodisme, antara lain gejala hidung tersumbat, sakit kepala, iritasi selaput lendir, ruam kulit.
Untuk lingkungan alam
Ini diklasifikasikan sebagai polutan beracun. Itu harus dijauhkan dari sumber air dan saluran air. Untuk mencegahnya dari kontaminasi, tanggul harus dibangun kapan pun diperlukan untuk menahannya.
Ini sangat beracun bagi kehidupan akuatik dengan efek yang berlangsung dari waktu ke waktu, karena bioakumulasi.
Referensi
- Lide, DR (editor) (2003). Buku Pegangan CRC Kimia dan Fisika. Pers CRC ke- 85 .
- Perpustakaan Kedokteran Nasional AS. (2019). Timbal iodida. Dipulihkan dari pubchem.ncbi.nlm.nih.gov.
- Kapas, F. Albert dan Wilkinson, Geoffrey. (1980). Kimia Anorganik Lanjut. Edisi keempat. John Wiley & Sons.
- Evstropiev; SK dkk. (2020). Sintesis dan Karakterisasi PVP / PbI 2 . Adv Compos Hybrid Mater 3, 49-57 (2020). Dipulihkan dari link.springer.com.
- Ismail, RA dkk. (2016). Sintesis nanopartikel PbI 2 dengan ablasi laser dalam metanol. J Mater Sci: Mater Elektron 27, 10696-10700 (2016). Dipulihkan dari link.springer.com.
- Bahan Azo. (2013). Memimpin Iodida (PBI 2 ) Semikonduktor. Dipulihkan dari azom.com.
- CDH (2008). Timbal (II) Iodida. Lembar Data Keamanan Bahan. Dipulihkan dari chdfinechemical.com.
- Hailegnaw, B.et al. (2015). Hujan pada Perovskit Berbasis Methylammonium Lead Iodide: Kemungkinan Efek Lingkungan Sel Surya Perovskite. J. Fisika. Kimia. Lett. 2015, 6, 9, 1543-1547. Dipulihkan dari pubs.acs.org.
- Yayasan Wikimedia (2020). Timbal(II) iodida. Dipulihkan dari en.wikipedia.org.