Peroksida adalah senyawa-senyawa kimia yang mengandung gugus perokso, OO, baik secara kovalen terikat atom karbon atau kelompok fungsional lainnya, atau anion ion dan peroksida, O 2 2- . Di atas diwakili secara grafis pada gambar di bawah ini. Di dalamnya, grup OO disorot dengan warna biru.
Mungkin ada peroksida organik seperti diakil peroksida (R 1 -OOR 2 ), hidroperoksida (ROOH), perasam (RCO-OOH), dan perester (R 1 CO-OOR 2 ). Kita juga memiliki peroksida anorganik, seperti peroksida logam (M n + O 2 2- ) dan hidrogen peroksida (HOOH). Yang terakhir adalah yang paling terkenal, menerima nama hidrogen peroksida.
Rumus untuk berbagai jenis peroksida yang ada. Sumber: Jü / Domain publik
Semua peroksida memiliki kesamaan sifat yang sangat reaktif, pengoksidasi dan, dalam beberapa kasus, bahan peledak. Kecuali jika tidak diperlukan untuk disintesis, mereka dianggap pengotor yang tidak diinginkan dan berbahaya untuk banyak proses industri dan untuk sintesis laboratorium.
Peroksida secara umum adalah pengoksidasi yang sangat baik, pemutihan, agen bakterisida, dan aktivator polimerisasi melalui pembentukan radikal bebas. Itulah sebabnya mereka biasanya reagen atau aditif yang sangat berguna dalam industri polimer, serta dalam industri makanan untuk mempercepat oksidasi dan menghilangkan bakteri.
Sifat peroksida
Struktur
Struktur peroksida berpusat di sekitar gugus OO. Setiap atom oksigen memiliki hibridisasi sp 3 , sehingga ikatan -OO- tidak terletak pada bidang yang sama. Misalnya, untuk hidrogen peroksida, HOOH, sudut yang terbentuk antara dua Hs adalah 115,5º, yang menunjukkan bahwa keempat atom tidak berada pada satu bidang.
Distorsi sudut ini dan sudut lainnya akan tergantung pada identitas fragmen molekul lain yang terkait dengan gugus OO.
Di sisi lain, peroksida organik dan anorganik (dengan pengecualian yang logam) dapat dikenali dengan mata telanjang jika kelompok OO dirinci dalam strukturnya, seperti dua gelas dengan “mulut”. Dengan cara ini, setiap peroksida segera diidentifikasi dengan melihat sekilas strukturnya.
Reaktivitas
Ikatan OO relatif lemah dibandingkan dengan ikatan lain seperti CH atau CO. Itulah mengapa ia cenderung pecah atau terfragmentasi untuk menghasilkan radikal teroksigenasi yang sangat reaktif.
Hal ini karena radikal ini yang peroksida diklasifikasikan sebagai zat reaktif dan berbahaya, karena mereka dapat merusak jaringan dan setiap organik peduli pada umumnya.
Tindakan oksidasi
Peroksida adalah agen pengoksidasi yang kuat, berusaha untuk mendapatkan elektron dari lingkungan untuk berubah menjadi air, oksigen, atau hidroksida. Misalnya, hidrogen peroksida adalah zat pengoksidasi yang lebih kuat daripada kalium permanganat itu sendiri.
Tindakan pengoksidasi ini digunakan untuk mendeteksinya melalui reaksinya dengan besi sulfat dan kalium tiosianat:
Peroksida + Fe 2+ + SCN – → Fe (SCN) n (3-n) – (n = 1 sampai 6).
Kompleks yang terbentuk antara Fe 3+ dan SCN – berwarna merah darah, sehingga pengamatan warna ini sesuai dengan uji positif untuk adanya peroksida dalam sampel.
Kepekaan
Peroksida adalah zat yang sensitif terhadap suhu tinggi dan sinar matahari. Oleh karena itu, mereka harus disimpan di tempat yang aman dan dalam wadah plastik buram, sedemikian rupa sehingga cahaya tidak langsung menyinari mereka.
Tata nama
Nomenklatur peroksida tergantung pada jenisnya. Secara umum, banyak yang diberi nama dengan menyebutkan ‘peroksida’ diikuti oleh substituen R dalam urutan abjad. Misalnya, senyawa CH 3 C (O) OOC (O) CH 3 (gambar bawah) disebut diacetyl atau asetil peroksida, karena memiliki gugus asetil di setiap ujungnya.
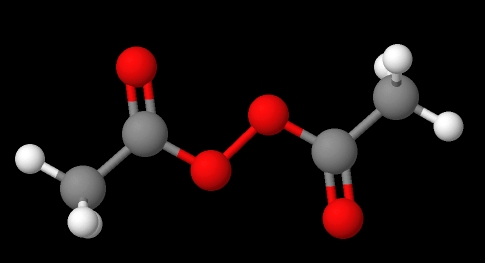
Diacetyl peroksida. Sumber: Gabriel Bolívar melalui MolView.
Senyawa C 6 H 5 C (O) OOC (O) C 6 H 5 (gambar bawah), di sisi lain, disebut dibenzoil atau benzoil peroksida, untuk alasan yang sama yang dibahas dalam paragraf sebelumnya.
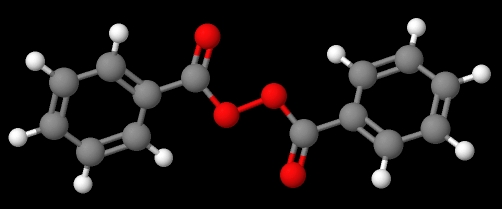
Benzoil peroksida. Sumber: Gabriel Bolívar melalui MolView.
Sedangkan senyawa C 6 H 5 C (O) OOC (O) CH 3 disebut asetil benzoil peroksida. Kali ini substituen asetil disebutkan terlebih dahulu dengan diawali huruf ‘a’. Contoh lain adalah CH 3 CH 2 OOC 6 H 5 , yang disebut etil fenil peroksida.
Dengan cara yang sama, kita melanjutkan dengan hidroperoksida. Misalnya, CH 3 OOH disebut metil hidroperoksida.
Pelatihan
Beberapa peroksida dapat dibentuk secara langsung dengan pemaparan zat yang bersangkutan dengan oksigen di udara, dibantu atau tidak dengan katalis logam. Mereka juga dapat dibentuk dengan memaparkan zat ke ozon dalam kondisi tertentu, melakukan reaksi ozonolisis.
Rute sintetis lainnya adalah mereaksikan hidrogen peroksida dengan alkil sulfat:
R 2 SO 4 + H 2 O 2 → ROOR + H 2 SO 4
Untuk mensintesis atau membentuk dialkil peroksida atau bahkan peroksida siklik.
Sementara itu, beberapa metode untuk membentuk peroksida logam didasarkan pada oksigenasi oksida logamnya masing-masing, sehingga mereka “mengoksigenasi” dan berubah dari MO (M n + O 2- ) menjadi MO 2 (M n + O 2 2- ).
Kegunaan peroksida
Inisiator polimerisasi
Peroksida, terutama peroksida organik, ditambahkan ke media reaksi untuk sintesis tak terhingga plastik dan bahan seperti polistirena, silikon, epoksi dan resin akrilik, polivinil klorida, fiberglass, antara lain.
Ini karena mereka mengalami dekomposisi termal menjadi radikal bebas teroksigenasi, yang pada gilirannya memicu dan mengkatalisis polimerisasi. Oleh karena itu, mereka diinginkan dalam industri polimer.
Beberapa peroksida yang digunakan sebagai inisiator adalah metil etil keton (MEK) peroksida, dan aseton peroksida.
Pemutih dan desinfektan
Peroksida adalah zat pemutih, digunakan untuk pemutihan pulp kertas dan tepung. Demikian juga, mereka adalah agen desinfektan, benar-benar efektif meskipun agresif dalam hal pemusnahan bakteri. Contoh klasik sesuai dengan hidrogen peroksida, digunakan dalam larutan encer (3%) untuk mendisinfeksi luka.
Agen pengoksidasi
Peroksida juga merupakan agen pengoksidasi, itulah sebabnya mereka menemukan banyak kegunaan dalam sintesis organik zat yang sangat teroksigenasi.
Sumber oksigen
Meskipun bukan salah satu kegunaan utamanya, peroksida juga dapat berfungsi sebagai sumber oksigen dalam beberapa penguraiannya. Ini adalah kasus, sekali lagi, hidrogen peroksida.
Contoh peroksida
Akhirnya, beberapa contoh peroksida, baik organik atau anorganik, dengan rumus dan nama masing-masing akan dicantumkan:
- H 2 O 2 : hidrogen peroksida atau hidrogen peroksida
- Na 2 O 2 : natrium peroksida
- BaO 2 : barium peroksida
- C 6 H 5 C (CH 3 ) 2 OOH: kumena hidroperoksida
- (NH 4 ) 2 S 2 O 8 : amonium persulfat
- HO 3 SOOSO 3 H: asam peroksidisulfat
- (CH 3 ) 3 COOC (CH 3 ) 3 : ditert-butil peroksida
Referensi
- Graham Solomons TW, Craig B. Fryhle. (2011). Kimia Organik. ( edisi ke- 10.). Wiley Plus.
- Carey F. (2008). Kimia Organik. (Edisi keenam). Bukit Mc Graw.
- Menggigil & Atkins. (2008). Kimia Anorganik. (Edisi keempat). Bukit Mc Graw.
- Wikipedia. (2020). Peroksida organik. Dipulihkan dari: en.wikipedia.org
- Elsevier BV (2020). Peroksida. Ilmu Langsung. Diperoleh dari: sciencedirect.com
- Pengembangan Kimia Lanjutan. (sf). Alkohol, Fenol, dan Turunannya:
- Peroksida Aturan C-218. Dipulihkan dari: acdlabs.com
- Vol’nov II, Petrocelli AW (1966) Klasifikasi dan Nomenklatur Senyawa Peroksida Anorganik. Dalam: Petrocelli AW (eds) Peroksida, Superoksida, dan Ozonida dari Logam Alkali dan Alkali Tanah. Springer, Boston, MA.